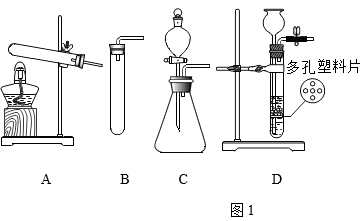
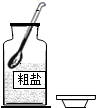
 取氯化钠
B .
取氯化钠
B . 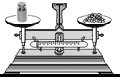 称取
C .
称取
C .  量液
D .
量液
D .  溶解
溶解

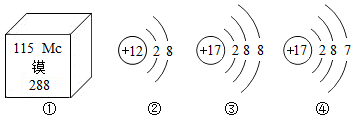
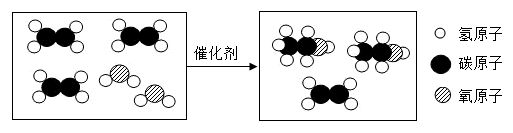
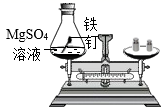 验证质量守恒定律
B .
验证质量守恒定律
B . 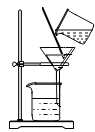 分离碘酒中的碘
C .
分离碘酒中的碘
C .  证明某化肥是铵态氮肥
D .
证明某化肥是铵态氮肥
D . 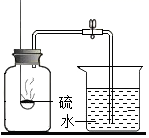 空气中氧气含量的测定
空气中氧气含量的测定
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | CaCO3(KNO3) | 水 | 加入水中,充分搅拌后过滤、蒸发 |
| B | CO(CO2) | 氧化铜 | 缓缓通过装有灼热氧化铜的玻璃管 |
| C | Zn(Fe) | 硝酸铜溶液 | 加入硝酸铜溶液,充分反应后过滤、洗涤、干燥 |
| D | NaCl(NaOH) | 稀盐酸 | 加入稀盐酸,充分反应后蒸发结晶 |
 图A在一定温度下,不断向一定量的水中加入氯化钾固体
B .
图A在一定温度下,不断向一定量的水中加入氯化钾固体
B . 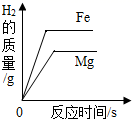 图B将等质量的镁片和铁片投入到足量稀硫酸中
C .
图B将等质量的镁片和铁片投入到足量稀硫酸中
C . 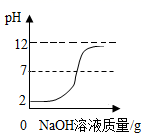 图C向pH=12的氢氧化钠溶液中加入pH=2的稀盐酸
D .
图C向pH=12的氢氧化钠溶液中加入pH=2的稀盐酸
D . 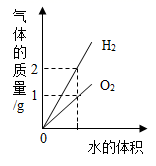 图D电解水生成氢气和氧气质量
图D电解水生成氢气和氧气质量

I.取少量溶液甲于试管中,滴加酚酞溶液,观察到溶液呈红色;
II.取一定量白色固体乙于烧杯中,逐渐加入溶液甲至过量并不断搅拌,烧杯内固体的质量随加入溶液甲的质量的变化如图中折线ABC所示;

III.继续向烧杯中滴加过量的稀硝酸,搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图中CD所示;
IV.再继续向烧杯中滴加硝酸银溶液,烧杯内固体的质量随加入硝酸银溶液的质量的变化如图中DE所示。
请回答下列问题:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
硫酸的质量分数/% |
98 |
98 |
80 |
80 |
70 |
40 |
|
温度/℃ |
120 |
200 |
120 |
200 |
200 |
200 |
|
铜粉消失的时间/s |
400 |
200 |
500 |
280 |
不消失 |
不消失 |
|
方案 |
原料 |
预期反应的化学方程式 |
依据的反应规律 |
|
① |
|
|
金属氧化物与酸反应生成盐和水 |
|
② |
|
|
|

查阅资料知:I.LiCl的熔点是605℃、沸点是1350℃;
II.NH4Cl在100℃开始分解,337.8℃分解完全,NH3和HCl在常温下又能反应生成NH4Cl固体;
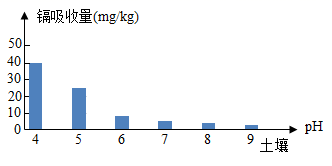
III.当溶液pH=5时,Fe3+和Al3+已沉淀完全。
a.NaOH
b.(NH4)2SO4
c.NH3·H2O
d.K2CO3