 C . HClO的结构式:H-Cl-O
D . 上述参与反应的各物质都是共价化合物
C . HClO的结构式:H-Cl-O
D . 上述参与反应的各物质都是共价化合物

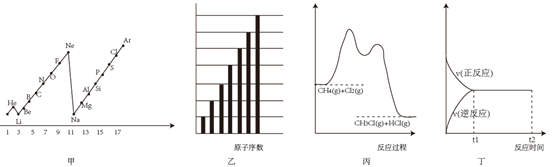
①铜为负极,锌为正极;
②铜极上有气泡;
③SO 向Zn极移动;
④锌发生还原反应;
⑤在外电路中,电子的流向是从锌到铜;
⑥正极反应式:2H++2e-=H2↑
| …….. | C | |||
| A | B | …….. | D |
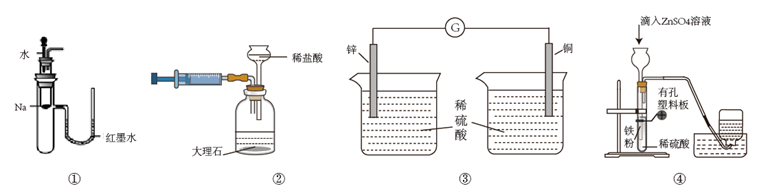
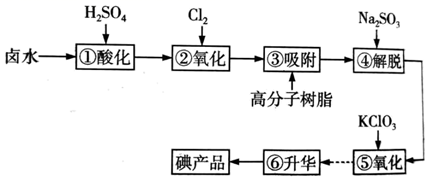

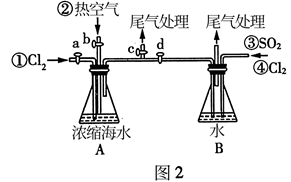
当进行②步骤时,应关闭活塞,打开活塞;步骤①中选择Cl2作氧化剂的依据是(请用元素性质的递变规律解释)。
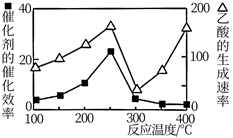
I.我们可以二氧化钛表面覆盖Cu2Al2O4为催化剂,将CO2和CH4转化成乙酸,CO2(g)+CH4(g) CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
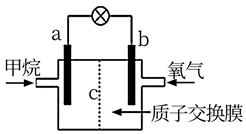
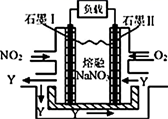
该燃料电池的正极为:(填“a”或“b”)。a电极反应方程式:。b电极反应方程式:。
|
族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
|
一 |
||||||||
|
二 |
① |
② |
||||||
|
三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |

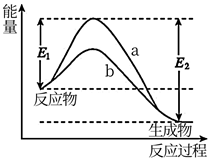
①该反应属于(填“吸热”或“放热”)反应。
②写出N2H4中含有的共价键类型:。
③若该反应过程中N2H4中有8mol极性键发生断裂,则能量变化为kJ。
|
物质 |
NH3 |
H2O |
N2 |
O2 |
|
断裂1mol化学键所需能量/kJ |
391 |
463 |
942 |
496 |
则68g氨气完全燃烧生成氮气和气态水放出的热量为kJ。