
 B . S2-的结构示意图:
B . S2-的结构示意图:  C . 氨的电子式:
C . 氨的电子式: 

 B .
B .  C .
C .  D .
D . 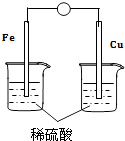
| 选项 | A | B | C | D |
| 反应装置或图像 | | | | |
| 实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |


|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
⑥ |
⑧ |
⑩ |
|||||
|
3 |
① |
③ |
⑤ |
⑦ |
⑨ |
|||
|
4 |
② |
④ |

|
a.酸性:H2CO3>H2SiO3 |
b.原子半径:O<C<Al<Si |
|
c.稳定性:H2O>CH4>SiH4 |
d.离子半径:O2-<Al3+ |



实验操作步骤:
①打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
②A中看到白色沉淀时,…,关闭活塞a。
请回答:
A.挥发性 B.还原性 C.氧化性 D.酸性

| a.电流计指针偏转 |
| b.Cu极有H2产生 |
| c.H+向负极移动 |
| d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是(填序号)。
②请写出该电池的负极反应式。
③若有1mol电子流过导线,则理论上产生H2的质量为g。