| | | | |
| A | B | C | D |
| | | | |
| 加热装置中的烧杯分离SiO2和NaCl | 验证镁和稀盐酸反应的热效应 | 制取并收集干燥、纯净的NH3 | 配制一定物质的量浓度的稀硫酸 |
| A | B | C | D |



| t/s | 2 | 4 | 7 | 8 |
| n(C)/mol | 0.12 | 0.10 | 0.09 | 0.09 |
①通入空气的一极的电极反应式为。
②电子从(填“Al”或“空气”,下同)极流向极。
③若将金属镁和铝设计成如图所示的原电池,镁作该原电池的(填“正极”或“负极”),请写出该电极的电极反应式:。

Ⅰ.共价键的键能是指形成1mol某种共价键的过程中所放出的能量或断裂1mol某种共价键的过程中所吸收的能量。显然共价键的键能越大,该共价键越牢固,含有该共价键的分子越稳定。如H—H键的键能是436kJ·mol-1 , 是指使1molH2分子变成2molH原子需要吸收436kJ能量。
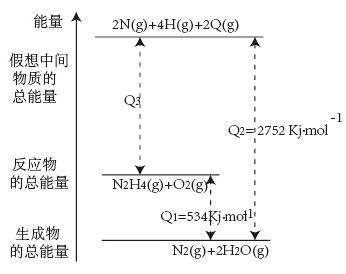
1molN2H4(g)和1molO2(g)生成2molN原子、4molH原子、2molO原子的过程中(填“吸收”或“放出”)kJ能量。
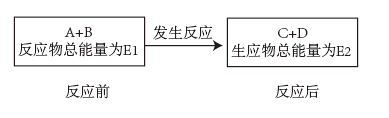
若E1>E2 , 则该反应为(填“放热反应”或“吸热反应”)。

①将容器的体积变为3L,化学反应速率。
②加入少量的碳,化学反应速率。

①a=(保留两位有效数字);
②7min时,正反应速率(填“>”、“<”或“=”)逆反应速率,此时混合气体的平均相对分子质量为(保留三位有效数字)。