 )是花香型香料,下列对苯乙酸苄酯的相关分析正确的是( )
)是花香型香料,下列对苯乙酸苄酯的相关分析正确的是( )
 和
和  C . 其苯环上的一溴代物最多有3种
D . 苯乙酸苄酯易溶于水及乙醇
C . 其苯环上的一溴代物最多有3种
D . 苯乙酸苄酯易溶于水及乙醇




将MnO2固体与KOH固体混合加热熔融得到K2MnO4 , 化学方程式是。
A. ![]() B.
B. ![]() C.
C.  D.
D.  E.
E. ![]()
已知:K2MnO4在酸性或者中性的水溶液中易歧化

A中使用油浴加热的优点是。

已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
|
物质 |
CH4(g) |
CO(g) |
H2(g) |
|
燃烧热(kJ·mol-1) |
890.3 |
283.0 |
285.8 |
① ΔH=kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH(填“变大”、“变小”或者“不变”)
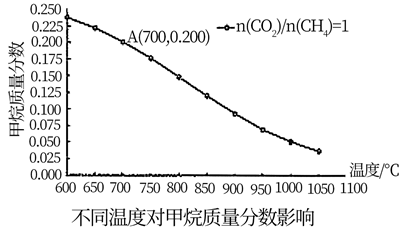
若充入a molCH4 , 经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=(用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
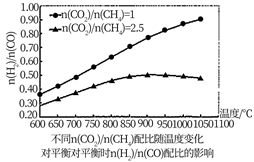
按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因。
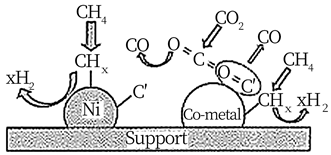
结合图示:
①写出一个可能的积碳反应方程式。
② 金属钴能有效消碳的原因是。
 。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。
。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。

①该化合物的化学式是。
②已知晶胞参数为5.93A,Si与Al之间的共价键长是(写出计算表达式)。
 回答下列问题:
回答下列问题:
反应i.  +NH3
+NH3

反应ii,其反应类型是。
 、
、  制备扑炎痛
制备扑炎痛  的合成路线(其它试剂任选)。。
的合成路线(其它试剂任选)。。 +
+  +NaCl
+NaCl