| A | B | C | D |
| | | | |
| 复原变形金属 | 补配玉器缺损 | 青铜器除锈见新 | 剥离丝绸残片 |
 D . 溴乙烷的官能团:-Br
D . 溴乙烷的官能团:-Br
 )具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如图所示,下列说法错误的是( )
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如图所示,下列说法错误的是( ) 
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
| A | B | C | D |
| | | | |
| 实验室制取蒸馏水 | 实验室制取氨气 | 除去CO2中的少量HCl | 收集NO2 |


a.稀 b.氨水c.
溶液d.
溶液
第一步:
第二步:
①写出上述合成尿素的热化学方程式。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入 和
,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。
a.选择低能量的反应物和 反应获得高能量的生成物
b.利用电能、光能或热能活化 分子
c.选择高效的催化剂
①提高 平衡转化率,可采取的措施。
② ℃时,2L密闭容器中,充入
和
,
随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | …… |
| | 2 | 1.4 | 1.0 | 0.65 | 0.4 | 0.4 | …… |
℃时,该反应的化学平衡常数(K)的代数式是。

①阳极反应的电极反应物是。
②结合电极反应式,说明阴极区pH升高的原因。
Ⅰ.将粗锰粉加入盐酸中充分反应,再加入NaOH溶液调节pH=6,过滤;
Ⅱ.向Ⅰ所得滤液中加入 酸性溶液,充分反应后加入
调节
,过滤;
Ⅲ.向Ⅱ所得滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
Ⅳ.浓缩、结晶、分离、干燥,得到产品
已知:生成氢氧化物沉淀的pH
| | | | | |
| 开始沉淀时 | 6.5 | 1.5 | 8.1 | 6.5 |
| 完全沉淀时 | 8.3 | 2.8 | 10.1 | 8.5 |
注:金属离子的起始浓度为0.1mol/L
①结合表中数据,解释步骤Ⅱ中加入 酸性溶液的目的:。
②配平加入 后发生反应的离子方程式:
,
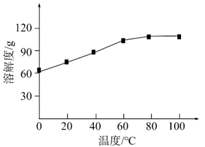
步骤Ⅲ所得滤液中仍含有少量易溶杂质,补充步骤Ⅳ浓缩、结晶的操作:将滤液,析出晶体后过滤。重复操作2~3次,收集晶体。

已知:同浓度的稀溶液中氧化性: 。
| 实验 | 现象 | |||
| | 编号 | 溶液X | ||
| Ⅰ | | 1小时内溶液颜色始终保持无色 | ||
| Ⅱ | | 溶液黄色立即加深,30s后溶液变为褐色,无浑浊 | ||
| Ⅲ | | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有 | ||
| Ⅳ | | 迅速变浑浊,离心分离后上层溶液为无色(经检测无 | ||

实验结论:在反应体系中,各物质的浓度对氧化还原反应的发生有一定的影响。