| A.制取并收集乙烯气体 | B.制取并收集氨气 |
| | |
| C.制取乙酸乙酯 | D.铁粉与水蒸气反应 |
| | |
资料:
①RH—10Fe是常温下以溶剂萃取和溶胶凝胶法,利用Fe(NO3)3溶液和稻谷壳中提取的硅酸盐材料制得的Fe-Si催化剂。
②硅酸盐材料具有多孔状结构,热稳定性佳,可用作催化剂载体。


| 选项 | 甲 | 乙 | 丙 | 丁 | 物质间的转化 |
| A | CuO | CO2 | CO | C | |
| B | Fe | Fe(NO3)2 | Fe(NO3)3 | HNO3 | |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NH3·H2O | |
| D | CO2 | NaHCO3 | Na2CO3 | NaOH |
| 选项 | c(H2)/mol/L | c(CO)/mol/L | c(CH3OH)/mol/L |
| A | 1.00 | 0.10 | 1.00 |
| B | 0.10 | 2.00 | 0.05 |
| C | 0.02 | 5.00 | 0.30 |
| D | 0.15 | 0.10 | 0.60 |

| 实验 | 0~1h | 1h | 2h | |
| 1 | 6mol/L盐酸 | 无气泡产生 | ||
| 2 | 3mol/L硫酸 | 无气泡产生 | 黄铜表面出现少量小气泡,反应缓慢 | 黄铜表面小气泡数量增加不明显,反应缓慢 |
| 3 | 6mol/L硝酸 | 2min时出现较多气泡,反应迅速进行;10min时出现明显的红棕色气体 | 溶液变为蓝色,反应持续进行,但不剧烈 | 溶液变为蓝色,反应持续进行,较为缓慢 |
| 4 | 2mol/L硝酸 | 黄铜表面出现少量小气泡,反应缓慢 | 溶液出现淡蓝色,反应缓慢 | 溶液出现淡蓝色,反应缓慢 |
| 4 | 浓硝酸 | 反应物接触后迅速反应,反应剧烈,产生大量红棕色气体,溶液变为深蓝色 | ||
依据上述实验,所得结论错误的是( )
热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为。

在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__。

已知:i.J的核磁共振氢谱峰面积比为6:4:2:1。
ii.R1—CHO+R2—NH2 R1—CH=N—R2+H2O。
a.D比丙醇的沸点高
b.F与乙酸互为同系物
c.J可以发生水解反应生成氨基酸
d.K可以与盐酸反应生成相应的盐
①可以发生银镜反应和水解反应
②核磁共振氢谱有三组峰

资料:
P2O4为磷酸二异辛酯(可用HA表示),不溶于水,是一种弱酸性萃取剂。其酸根离子(A-)可与某些金属离子发生反应。

NiSO4在不同温度下的溶解度
|
温度/℃ |
20 |
30 |
40 |
60 |
80 |
90 |
100 |
|
溶解度/g |
44.4 |
46.6 |
49.2 |
55.6 |
64.5 |
70.1 |
76.7 |
资料
①水溶液中存在平衡:2Cl-(aq)+CuCl(s) CuCl
(aq)。
②CuCl是难溶于水的白色固体,在热水中迅速水解生成Cu2O。
③CuCl在潮湿的空气中易被氧化,生成的碱式盐为Cu2(OH)3Cl。
Ⅰ.实验室中用纯净的CuCl2固体可制备CuCl。取75gCuCl2固体于烧杯中,加入100mL0.2mol/L盐酸和水配成200mL溶液,然后在溶液中通入SO2气体。

“酸浸”中,加入稀H2SO4不宜过量太多的原因是__。

| 实验方案 | 实验现象 |
| | i.溶液先变黄色,迅速变为棕色 ii.将棕色溶液加热,颜色变浅,冷却 |
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
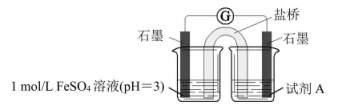
①右侧烧杯中试剂A是。
②实验证据是。