
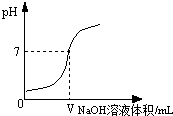
猜想Ⅰ:pH增大是因为;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式;
为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
①向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7;
②向2mL0.4%的盐酸中加入VmL , 用pH计测得混合液的pH7(填“>”、“=”或“<”);综合①和②证明猜想Ⅱ成立。
【提出问题】镁是否能与水反应?
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂。实验过程和现象如图:

【反思与总结】
猜想 | 验证方案 |
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱 | 将褪色后的溶液 , 如果溶液变红,说明小明的猜想正确 |
小明通过实验证明了自己的猜想是正确的。
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氯化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液;
步骤2:取少量步骤1中的滤液与试管中,滴加2滴酚酞试液,溶液变成红色。结论:白色固体的成分是氧化钠。

实验1:用pH试纸测试滤液 pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填“实验1”或“实验2”)
方案一:样品 测定生成CO2的质量。
方案二: ![]()
具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。

资料二:测量SO2含量的反应原理为SO2+2H2O+I2=H2SO4+2HI,
资料三:加了生石灰的原煤燃烧时可减少SO2排放,反应原理为2CaO+2SO2+O2=2CaSO4。
请回答: