
| 实验目的 | 实验操作 | 实验原理 | |
| A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| B | 比较 | 向 | |
| C | 探究化学反应的限度 | 取 | 根据溶液中既含 |
| D | 检验溶液中是否含有 | 取少量试液于试管中,加入 | |

| 反应条件 | 反应时间 | | | | |
| 反应Ⅰ: 恒温恒容 | 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | ||||
| 20 | 1 | ||||
| 30 | 1 | ||||
| 反应Ⅱ: 绝热恒容 | 0 | 0 | 0 | 2 | 2 |
下列说法正确的是( )


下列有关电池叙述错误的是( )

| 实验步骤 | 实验操作 |
| 第一步 | 连接实验装置并检查装置气密性 |
| 第二步 | A、C、D中装入药品,加热A中试管,通过pH数据采集器控制C中反应至 |
| 第三步 | 将C中所得溶液转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥制得焦亚硫酸钠( |
已知: ;
,实验装置如下:

回答下列问题:

①取100.00 饮料于锥形瓶中,加入
的
溶液,塞紧瓶塞充分反应。
②打开瓶塞,将锥形瓶内液体调至接近中性,滴加4~5滴淀粉溶液变蓝。用 的
溶液滴定,滴定至终点时,消耗
;溶液39.80
,饮料中残留的
为
(计算结果保留两位小数)。
②T温度时,向2L密闭容器中加入 ,
时
完全分解,体系达平衡状态,气体压强是反应前的2倍,则该温度下
的平衡常数K=。
③ ,在体积均为
的容器中,不同温度下二氧化氮浓度变化与反应时间的关系如图所示,下列说法错误的是(填标号)。
 A.
A.
B.a点逆反应速率小于c点正反应速率
c。 ℃ 10
时二氧化氮速率为0.05
D. ℃ 20
时改变的条件可能是充入一定量的
②Peter提出了一种用惰性电极作阳极硝酸电解脱水法制备 ,其原理如下图所示。阳极制得
和A,其电极反应式为。每生成1
,两极共产生气体L(标准状况下)。

②P与N同主族,气态氢化物的沸点:
(填“>”或“<”),说明理由:。

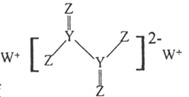
①则其化学式为。
②该晶体中距离 原子最近的
原子有个,在晶胞中由
原子构成的八面体与由
和
原子构成的八面体的个数之比为。
③若晶体密度为 ,最近的
原子核间距为
(用含
、
的代数式表示)。
a.不溶于水b.能与 发生还原反应
c.能被酸性重铬酸钾溶液氧化d.与金属 发生置换反应
①苯环上有两个取代基;②含有碳碳双键;③能发生银镜反应。