
| 选项 | 实验操作和现象 | 结论 |
| A | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
| B | 室温下,向 | 镁与盐酸反应放热 |
| C | 室温下,向浓度均为 | 白色沉淀是BaCO3 |
| D | 向 | H2O2具有氧化性 |




①X为(填化学式)。
②电极a的电极反应式为。
③装置若无阳离子交换膜(填“能”或“不能”)得到Na2S2O4。

①盛放浓硫酸的仪器名称为;写出装置A烧瓶内反应的化学方程式:。
②通入SO2前装置B的三颈烧瓶内应先通入N2 , 目的是。通入SO2 , 控制反应温度约为35℃,反应一段时间后再滴加NaOH溶液将有Na2S2O4和Zn(OH)2生成。控制反应温度约为35℃的方法是,写出生成Na2S2O4和Zn(OH)2总反应离子方程式:。
③将反应后的悬浊液过滤后在微热下加入氯化钠冷却至20℃,析出Na2S2O4结晶过滤后,再用乙醇洗涤几次后,置于真空干燥箱中干燥即得到Na2S2O4。简述用乙醇洗涤的原因:。
称取mgNa2S2O4样品溶于冷水中配成100mL溶液,取出10mL该溶液置于预先盛有20mL中性甲醛溶液的烧杯中,搅拌至完全溶解,转移至250mL容量瓶中用水稀释至刻度摇匀。移取25mL该溶液于250mL锥形瓶中加入4mL盐酸溶液,用cmol·L-1的碘标准溶液滴定,近终点时加入3mL淀粉溶液继续滴定,至溶液呈浅蓝色在30s内颜色不消失,用去碘标准溶液VmL。产品中Na2S2O4的质量分数为。
已知:Na2S2O4+2CH2O+H2O=NaHSO3∙CH2O+NaHSO2∙CH2O
NaHSO2∙CH2O+2I2+2H2O=NaHSO4+CH2O+4HI

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5 , Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2 , Ka2(H2C2O4)=1.6×10-4。
回答下列问题:

主要热化学反应如下:
I.2Ni(s)+O2(g)=2NiO(s) ∆H=-479.8kJ∙mol-1
II.CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ∆H=+68.9kJ∙mol-1
①CH4的燃烧热是。
②与直接燃烧CH4相比“化学链燃烧”的优点为。
a.燃烧等质量的CH4 , 放出的热量多
b.有利用于二氧化碳的分离与回收
c.燃烧等质量的CH4 , 消耗的O2少
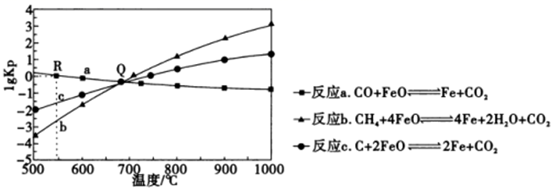
①R点对应温度下向某恒容密闭容器中通入1.0molCO和0.2molCO2 , 并加入足量的FeO,只发生反应a:CO(g)+FeO(s)=CO2(g)+Fe(s),则CO的平衡转化率为。
②若某恒容密闭容器中只发生反应b和c,平衡时对应上图中Q处时,容器中气体分压p(X)间应满足的关系是。
①T℃下该反应的Kp=。
②其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率(填“增大”“减小”或“不变”)。
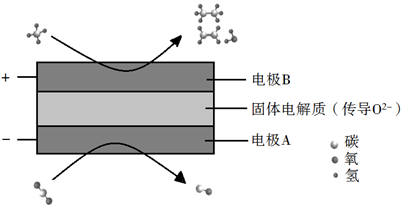
①写出生成乙烯的电极反应式为:。
②若生成的乙烯和乙烷的体积比为1:2,则消耗的CH4和CO2体积比为。

①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应
③有3个甲基
写出其中核磁共振氢谱有5组峰峰面积比为1:1:2:2:9的同分异构体结构简式:。