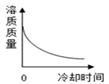
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
 B .
B .  C .
C .  D .
D . 
 B . 粗盐溶解
B . 粗盐溶解  C . 浊液过滤
C . 浊液过滤 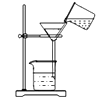 D . 蒸发结晶
D . 蒸发结晶 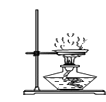

ABCD F


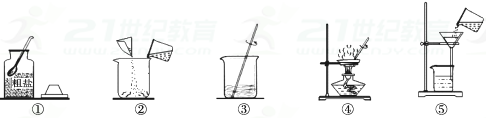
a.实验操作有错误的步骤是;
b.步骤③中玻璃棒的作用是;
实验四:操作⑤中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。

a.粗盐提纯实验的操作顺序为(填上述操作序号次序);
b.经操作⑥后滤液仍浑浊,原因可能是(答出一点即可);
c.④步骤中的玻璃棒有作用。
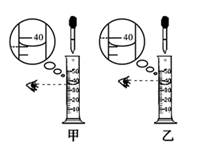
a、计算:可计算出需精盐克,需水毫升。
b.称量和量取:称量氯化钠时,若发现天平指针向左偏,则应怎么处理?。
C.溶解:经检测,所配制的氯化钠溶液的溶质质量分数偏小,其可能原因是。
A.所用的氯化钠固体中含有杂质
B.量取水时,仰视读数
C.将水倒入烧杯时,有少量水溅出
D.将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
E.将配制好的溶液转移进试剂瓶时,有溶液洒落

A.食盐没有全部溶解即过滤 B.过滤后滤液仍然浑浊就蒸发结晶
C.蒸发后,所得精盐很潮湿 D.称量最终的产品时,器皿上沾有的精盐没全部转移到天平上
工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
|
物质 |
K2CO3 |
K2SO4 |
KMnO4 |
|
溶解度/g |
111 |
11.1 |
6.34 |
若用稀H2SO4酸化,反应的化学方程式为:
3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
工业上不采用稀H2SO4酸化的原因是 .
电解法也可以实现由向K2MnO4向KMnO4的转化,反应的化学方程式为:
2K2MnO4+2H2O 2KMnO4+2KOH十H2↑
2KMnO4+2KOH十H2↑
与“通CO2酸化”相比,其优点是 .
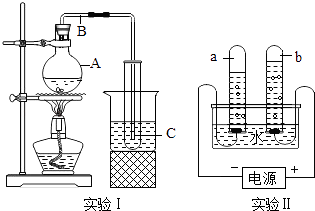
如图所示,实验Ⅰ是制备蒸馏水的装置,实验Ⅱ是电解水的装置.

1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
②2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
现有Na2CO3和NaCl的混合样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解,向所得溶液中逐渐加入溶质质量分数为7.3%的稀盐酸烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示,试回答下列问题:
①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为 (写化学式).
②在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为 g.
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量 (计算结果精确至0.1g)

②将自来水蒸馏得到纯净水,把下列物质分别加入纯净水中,用玻璃棒不断搅拌,能形
成无色溶液的是 (填字母)。
A.粉笔灰 B.硫酸铜
C.蔗糖 D.食用油
①带铁圈的铁架台 ②酒精灯 ③漏斗 ④玻璃棒 ⑤量筒 ⑥烧杯 ⑦滤纸
利用蒸发原理可以从海水中提取食盐,仅从①~⑦中选择仪器不能完成实验室蒸发食盐水的实验,还需要的仪器是 。