 验证质量守恒定律
B .
验证质量守恒定律
B .  测定空气中氧气含量
C .
测定空气中氧气含量
C .  探究铁钉锈蚀的条件
D .
探究铁钉锈蚀的条件
D .  探究燃烧条件之一:温度达到着火点
探究燃烧条件之一:温度达到着火点




⑴计算:配制100g溶质质量分数为5%的氯化钠溶液所需:氯化钠5g。
⑵称量:用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应;
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节平衡螺母 D.向右盘加砝码
⑶量取:用量筒来量取所需的水,若仰视读数,则配制后溶液的质量分数会;
⑷溶解:将氯化钠和水倒入烧杯中,溶解时玻璃棒搅拌的目的是;
⑸转移到试剂瓶中贴好标签。


(猜想假设)猜想1:没有变质是NaOH
猜想2:全部变质是Na2CO3
猜想3:部分变质,既有NaOH还有Na2CO3
(讨论交流)NaOH可能变质的原因是(用文字说明);
①取少量样品于试管中,加入足量的稀盐酸,有气泡冒出说明猜想1不成立;
②进一步探究过程如下:

根据上述探究过程回答:
①加入过量BaCl2溶液的作用是为了;
②不能用适量Ba(OH)2溶液代替过量的BaCl2溶液的原因是;
③下列溶液可用来代替酚酞溶液检验猜想3成立的是;
A.CuCl2溶液 B.KNO3溶液 C.CaCl2溶液 D.NH4NO3溶液并加热
(演示实验)将一定量的稀H4SO4加入到盛有NaOH溶液的小烧杯中
(学生板演)该反应的化学方程式 。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:。
乙组同学对以上猜想提出质疑,认为有一种精想三是不合理的,你的理由是:。
丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
|
实验方案 |
测溶液的pH |
滴加Na2CO3溶液 |
滴加BaCl2溶液 |
|
实验操作 |
| | |
| 实验现象 | 试纸变色,对比比色卡,pH<7 |
| 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
①实验操作中的不正确是把pH试纸伸入待测液体中;
②实验方案中也有一个是错误的,错误的原因是。


组装制取装置时,需选择上图中的A、G、H、L、M、N、O和;
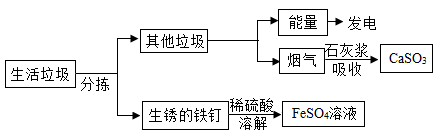
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题: