| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |
A.sp B.sp2 C.sp3 D.sp3d


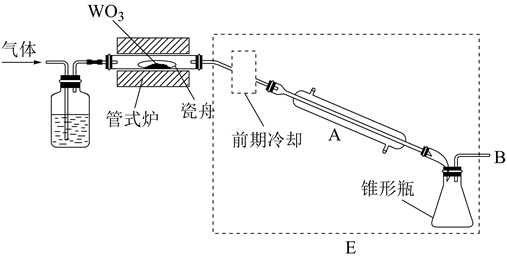
中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。

①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO
+Ba(IO3)2=BaWO4+2IO
;交换结束后,向所得含IO
的溶液中加入适量酸化的KI溶液,发生反应:IO
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
=2I-+S4O
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。
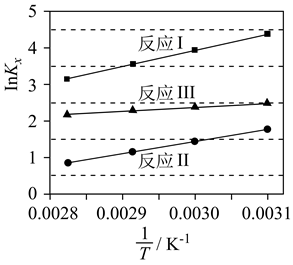
反应Ⅰ: ![]() +CH3OH
+CH3OH
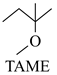 △H1
△H1
反应Ⅱ: ![]() +CH3OH
+CH3OH
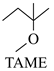 △H2
△H2
反应Ⅲ: ![]()
![]() △H3
△H3
回答下列问题:
A.<-1 B.-1~0 C.0~1 D.>1