 B .
B .  C .
C .  D .
D . 

| 实验目的 | 实验方案 | |
| A | 测定空气中氧气的体积分数 | 密闭容器中,点燃铁丝,记录容器内气压变化 |
| B | 去除铁钉表面的铁锈 | 放入稍过量的稀硫酸中,铁锈全部除去后立即取出 |
| C | 检验固体中是否含有碳酸盐 | 将待测样品放入稀盐酸中,观察是否有气泡产生 |
| D | 分离碳粉和氧化铜 | 加热至固体质量不再变化 |

①石墨、和碳60都是由碳元素组成的同素异形体。
②天然气(主要成分:CH4)是清洁的气态矿物燃料。CH4属于(选填“有机物”或“无机物”),由种元素组成,1molCH4中约含有个碳原子。
③固态二氧化碳称为干冰,可用于。
④一氧化碳可冶炼金属,其还原氧化铜的实验装置如图所示(夹持仪器省略)。A处玻璃管中反应的化学方程式是,B处观察到的现象是;C处尾气处理的目的是。

⑤盐碱湖地区有“冬天捞碱、夏天晒盐”的生产经验,其中“碱”指碳酸钠,“盐”指氯化钠。
I.碳酸钠的物质类别是(选填“酸”、“碱”或“盐”)。
II.碳酸钠、氯化钠的部分溶解度数据见下表。
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | |
| 溶解度 (g/100g水) | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
| 氯化钠 | 35.7 | 35.8 | 35.9 | 36.1 | 36.4 | |
由上表可知,溶解度受温度影响较大的物质是;“冬天捞碱”是获取湖水中析出的碳酸钠晶体,碳酸钠晶体的形成过程是(选填“降温结晶”或“蒸发结晶”)。

①A中反应的化学方程式是。
②B装置中生石灰作剂。
③D处可观察到的现象是。
④实验结束后,取少量锥形瓶中的溶液,滴加氯化钡溶液,可观察到的现象是,该现象是否能说明溶液中含有硫酸,理由是。
①检验样品成分
|
实验步骤 |
实验现象 |
结论 |
|
取样,溶于水中,滴加2滴酚酞试剂; |
溶液变为色 |
氢氧化钠样品中含有氯化钠,不含碳酸钠。 |
|
向上述溶液中滴加过量稀硝酸,再滴加溶液。 |
|
②测定样品纯度。
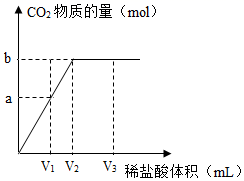
取1g样品配制成溶液后,滴加稀盐酸,测定相关数据,如下图所示。

I.发生反应的化学方程式是。
II.实验开始前应获知的数据是稀盐酸的密度和;实验后应选用的数据是(选填“a”“b”或“c”)。
III.经计算,最终参加反应的盐酸中溶质为0.02mol,则1g样品中氢氧化钠的质量是g。

①生成氧气的化学方程式是;采用图中的收集方法,是因为氧气。
②将红热的木炭放入集满氧气的集气瓶中,观察到的现象是。

收集一定量氧气后结束实验,为回收剩余固体中的二氧化锰,进行如下实验。
③20℃时氯酸钾、氯化钾的溶解度数据见下表(假设溶液中两种物质的溶解度相互无影响)
| 20℃的溶解度 | |
| 氯酸钾 | 7g/100g水 |
| 氯化钾 | 34g/100g水 |
请分析5.44g剩余固体的成分,并说明步骤III中水量约为40mL而不是30mL的原因。