①制取过氧化钠等化合物 ②制钠钾合金,作快中子反应堆的热交换剂 ③还原钛等金属 ④制高压钠灯
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
碳酸钠溶液可用于治疗胃病 |
Na2CO3可与盐酸反应 |
Ⅰ对,Ⅱ对,有 |
|
B |
向Na2O2的水溶液中滴入酚酞变红色 |
Na2O2与水反应生成氢氧化钠 |
Ⅰ对,Ⅱ错,无 |
|
C |
金属钠保存在煤油中,以隔绝空气 |
常温下,金属钠在空气中会生成过氧化钠 |
Ⅰ对,Ⅱ对,有 |
|
D |
过氧化钠可用于航天员的供氧剂 |
Na2O2能和CO2、H2O反应生成O2 |
Ⅰ对,Ⅱ对,有 |
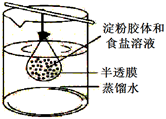
⑴ 钠与水反应(离方程式)
⑵ 除去碳酸氢钠容液中少量碳酸钠<离子方程式)
⑶ 除去碳酸钠固体混有的碳酸氢钠(化学方程式)
⑷ 镁在二氧化碳中燃烧(化学方程式)
⑸ 二氧化碳中混有少量氯化氢(离子方程式)


装置①中反应的离子方程式是。
装置②中的试剂是为了除去CO2中混有的HCl,则可选用的试剂为。
a.饱和NaOH溶液 b. 饱和Na2CO3溶液 c.饱和NaHCO3溶液
装置③中的试剂是。
步骤1:打开弹簧夹K2 , 关闭K1 , 打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1 , 关闭K2 , 打开分液漏斗活塞加入盐酸,将带火量的木条放在a处。
步骤1和步骤2中,a处带火星的木条产生的实验现象分别是、。
① KClO4的名称是,具有(填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作(填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:。
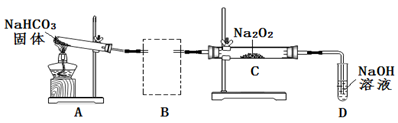
①根据实验目的,虚线框中的装置所用的试剂为。
②装置C中观察到的现象是,反应的化学方程式是。
③装置A的作用是制备CO2 , 写出A中发生反应的化学方程式是。

:,
:。

a.金属A浮在液面,并四处游动
b.金属A会熔化成一个小球
c.反应开始后,溶液由无色变成红色
d.恢复到室温时,烧杯底部有固体物质析出