
| A | B | C | D |
| 测量锌粒和3 mol/L硫酸反应生成H2的体积 | 制备并收集乙酸乙酯 | 加热熔融的纯碱固体 | 制取并收集SO2 |
| | | | |
| 选项 | 实验 | 现象 | 结论 |
| A | 向 | 生成两种沉淀 | |
| B | 向浓度均为 | 先出现浅蓝色沉淀 | |
| C | 向 | 有气体产生,一段时间后, | |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
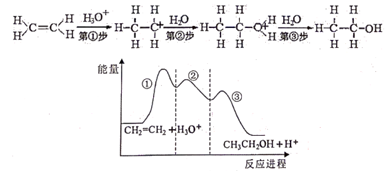
(电池总反应为: )



已知:① 的浓度较大时易分解爆炸,一般用
或空气稀释到
以下,实验室也常用稳定剂吸收
,生成
,使用时加酸只释放出
一种气体;
② 与
反应的离子方程式为:
;
③有关物质沸点如下表:
| 物质 | | | |
| 沸点 | | | |
请回答:


|
时间 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol•L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
① 内,
。
②达平衡时,反应体系吸收的热量为 (用Q表示)。
③该温度下反应2NO2(g)⇌N2O4(g)的化学平衡常数K=。

①Ir表面发生反应的方程式为。
②若导电基体上的Pt颗粒增多,造成的结果是。

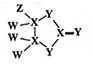
① 中阴离子的立体构型是;
②在 中
与
之间形成的化学键称为,提供孤电子对的成键原子是。
①遇氯化铁溶液发生显色反应 ②能发生水解反应、银镜反应