| A | B | C | D |
| | | | |
| 分离甲苯和水 | 浓硫酸的稀释 | 除去CO中的CO2 | 萃取振荡时放气 |
 D . HCl的电子式:H+[
D . HCl的电子式:H+[ 

②M2++EBT(铬黑T,蓝色)=MEBT(酒红色);
③MEBT+Y4-(EDTA)=MY2-+EBT。下列说法正确的是( )

| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | NH | 过量H2S | 2Fe3+ + H2S=2Fe2+ + S↓ + 2H+ |
| B | Fe2+、K+、NO | 少量HI | 4H++3Fe2++NO |
| C | NH | 过量铜粉 | 2Fe3+ +Cu=2Fe2+ + Cu2+ |
| D | AlO | 少量HCl | H+ +AlO |

| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴乙烷与氢氧化钠的乙醇溶液共热产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 不能说明溴乙烷与氢氧化钠的乙醇溶液共热生成了乙烯 |
| B | 将SO2通入BaCl2溶液中,然后滴加氯水 | 先有白色沉淀生成,滴加氯水后沉淀不溶解 | 先生成BaSO3沉淀,后被氧化为BaSO4 |
| C | 将电石与水反应产生的气体通入溴水 | 溴水褪色 | 生成的乙炔气体中含有H2S |
| D | 用(NH4)2S2O8溶液蚀刻铜制线路板 | 铜制线路板逐渐溶解 | S2O |
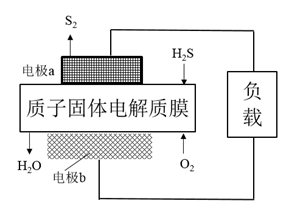

写出制备CaO2·8H2O的化学方程式;
a固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH−=2MnO(OH)2↓;
b氧化:酸性下,MnO(OH)2将I−氧化为I2;
c滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O +I2 =S4O
+ 2I-
某同学向100.00mL水中加一定量CaO2·8H2O,取此水样50.00mL,按上述方法测定水中溶氧量(DO),消耗 0.02 mol·L−1 Na2S2O3标准溶液 15.00 mL。
请写出步骤 b 中的离子方程式 ;

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
请回答下列问题:
NO2有较强的氧化性,能将SO2氧化成SO3 , 自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为。

①B、E两点对应的正反应速率大小为vBvE(填“>”或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为(填字母序号)。
T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为kPa∙min-1。
②T1℃时,反应的平衡常数Kp=kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。

a.氢键 b.离子键 c.π键

建立如图的原子坐标系,①号位的坐标为( ,
,
),则③号位原子坐标参数为。晶胞参数为a pm,阿伏加德罗常数的值为NA , 砷化镉的摩尔质量为M g·mol−1 , 则该晶胞的密度为g·cm−3(列计算式即可)。

已知:R- CHO
 ,R -CN
,R -CN RCOOH。
请回答下列问题:
 为有机原料制备化合物
为有机原料制备化合物  的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。