
反应①:Cu2S+Cr2O +H+→Cu2++SO
+Cr3++H2O(未配平)
反应②:FeS+Cr2O +H+→Fe3++SO
+Cr3++H2O(未配平)
下列判断错误的是( )

| 实验操作和现象 | 结论 | |
| A | 将溴乙烷和过量NaOH溶液混合共热并充分振荡,冷却后加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有发生取代反应 |
| B | 向淀粉溶液中加入几滴稀硫酸,煮沸,冷却后加入少量银氨溶液,水浴加热,无银镜生成 | 淀粉水解的产物没有还原性 |
| C | 向1mL0.1mol·L-1FeCl3溶液中滴加2mL0.1mol·L-1KI溶液,充分反应后,滴加几滴KSCN溶液变为红色 | FeCl3与KI的反应是可逆反应 |
| D | 将湿润的淀粉—KI试纸置于集满红棕色气体的集气瓶口,试纸变蓝 | 证明该气体为Br2 |

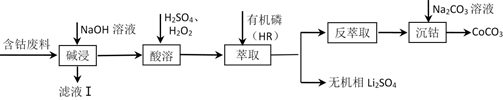
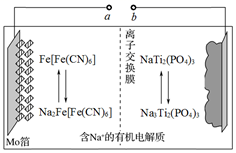
已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是( )
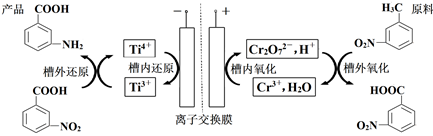
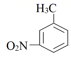 +Cr2O
+Cr2O 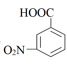 +2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
+2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸

a.离子键 b.共价键 c.配位键 d.氢键


|
物质 |
CH4(g) |
CO(g) |
H2(g) |
|
燃烧热(ΔH/kJ·mol-1) |
-890.3 |
-283.0 |
-285.8 |
则CH4—CO2催化重整反应的ΔH=kJ·mol-1。

①T1℃、100kPa下,n(平衡时气体):n(初始气体)=;该温度下,此反应的平衡常数Kp=(kPa)2(以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,点对应的平衡常数最小,理由是;点对应压强最大,理由是。

由图可知,75min后CH4转化率与炭催化剂目数的关系为,原因是。

已知:①有关物质在水和乙醇中的溶解性:
|
葡萄糖酸钙 |
葡萄糖酸锌 |
硫酸锌 |
硫酸钙 |
|
|
水 |
可溶于冷水,易溶于热水 |
易溶 |
微溶 |
|
|
乙醇 |
微溶 |
难溶 |
||
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTAl0.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为。
②该粗产品中Zn的质量分数为。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管
①能发生银镜反应;②能与FeCl3溶液发生显色反应。
 的合成路线(其它试剂任选)。
的合成路线(其它试剂任选)。

已知:V2O5微溶于水,可溶于碱生成VO 。向Na3VO4溶液中加酸,不同pH对应的主要存在形式如表:
| pH | ≥13 | 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
| 存在形式 | VO | V2O | V3O | V10O | V2O5 | VO |
回答下列问题: