CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2 , 测得不同温度下n(CH4)随时间变化的有关实验数据如下表,下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2 , 测得不同温度下n(CH4)随时间变化的有关实验数据如下表,下列说法正确的是( )
| 组别 | 温度/K | 物质的量/mol // 时间/min | 0 | 10 | 20 | 40 | 50 |
| ① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
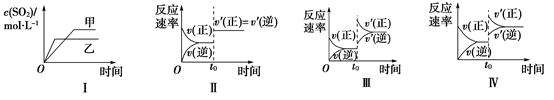
2Fe3+(aq)+2I-(aq) ![]() 2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )
2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )
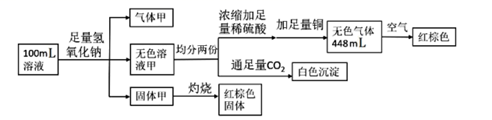
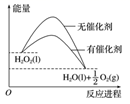
若AB电源是甲醇在酸性环境的燃料电池,则甲中C极的电极反应式为。
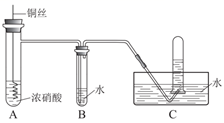
浓硝酸一般盛放在棕色试剂瓶中,原因是。
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH= - 246.4kJ·mol-1
它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1= - 205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2 = 。
问:①该反应的平衡常数表达式为:
②反应开始时正、逆反应速率的大小:v(正)v(逆)。(填“>”、“<”或“=”)
③平衡时CO的转化率=。
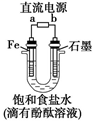
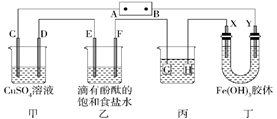
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数

请回答:
①以上步骤有错误的是(填编号)。
②滴定终点的现象为。
③用标准NaOH溶液滴定时,应将标准NaOH溶液注入 中(从图中选填“甲”或“乙”)。
④下列操作会引起实验结果偏大的是 ![]() 填编号
填编号 ![]() 。
。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.滴定终点俯视读数
D.用滴定管量取待测液时,开始时正确读数,后俯视读数
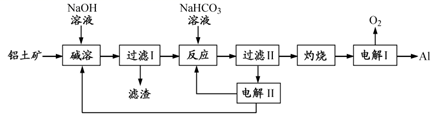
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
![]()
计算该样品中AlCl3的质量分数 (结果用m、n表示,不必化简)。