
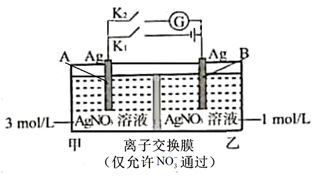



①a为电源(填“正极”或“负极”)。
②B膜应选择(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
|
实验步骤 |
现象 |
|
①取少量样品,加入蒸馏水 |
②固体完全溶解得无色澄清溶液 |
|
③ |
④ |
|
⑤静置, |
⑥出现白色浑浊 |
①仪器a的名称为。
②“浓硫酸酸化”的实验操作为
③样品纯度为%

①利用Na2S2O3溶液和KI溶液测定反应生成Cl2的物质的量,若消耗V1mLc1mol·L-1的Na2S2O3溶液,则生成Cl2mol(已知2S2O +I2=S4O
+2I-)。
② 表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当
=4、
=50g·min·mol-1时,每分钟流经1g催化剂的气体体积为L(折算为标准状况下)。
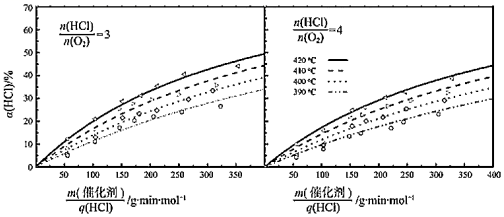
③在420℃、 =3、
=200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为mol·g-1·min-1。
④比较在下列两种反应条件下O2的反应速率:vⅠvⅡ(填“>”“=”或“<”)。
Ⅰ.410℃、 =3、
=350g·min·mol-1;
Ⅱ.390℃、 =4、
=350g·min·mol-1。

①360℃时反应的平衡常数K360与400℃时反应的平衡常数K400之间的关系是K360K400。(填“>”“=”或“<”)。
②一定温度下随着 的增大,HCl的平衡转化率(填“增大”“减小”或“不变”),原因为。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为。
②溶液中的水存在H3O+、 等微粒形式,
可看作是H3O+与H2O通过氢键形成的离子,则
的结构式为。
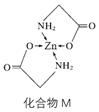
①1 mol M含有的σ键的数目为。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、 等,NH3的分子空间构型为,
的中心氮原子杂化方式为。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
|
卤化锌/ ZnX2 |
ZnF2 |
ZnCl2 |
ZnBr2 |
|
熔点/℃ |
872 |
283 |
394 |
则ZnX2熔点如表变化的原因是。

a.属于芳香族化合物;
b.与F具有相同的官能团;
c.核磁共振氢谱有5组峰,且峰面积之比为6:2:2:2:1。