
| 选项 | 生活用品 | 名称 | 主要成分 | 性质 |
| A | | PP塑料制作的奶瓶 | 聚丙烯 | 能够使酸性高锰酸钾褪色 |
| B | | 肥皂 | 高级脂肪酸钠 | 肥皂的水溶液呈碱性 |
| C | | 蜂蜜 | 葡萄糖、果糖和蔗糖 | 蔗糖在稀硫酸的作用下可水解生成葡萄糖和果糖 |
| D | | 阿胶 | 驴的皮去毛后熬制而成的胶块 | 在合适的酶的作用下能够发生水解反应 |
 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将少量BaSO4固体用饱碳酸钠溶液浸泡,过滤后向滤渣中加入HCl | 滤渣溶解,并产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
| B | 足量双氧水滴入酸性高锰酸钾溶液中 | 溶液褪色 | H2O2具有漂白性 |
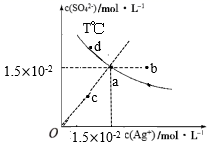
| C | 向溶液X中通入氯化氢气体 | 生成白色沉淀 | 溶液X中一定含有Ag+ |
| D | 常温下,用pH计测定0.1mol•L-1NH4CN溶液的pH | pH=8.6 | 电离平衡常数:K(NH3•H2O)>K(HCN) |
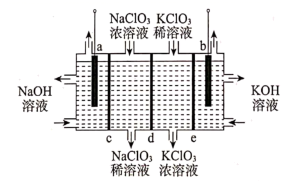

①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CCl4+Al2O3=3COCl2+2AlCl3
回答下列问题:
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数(选填“偏大”或“偏小”)。

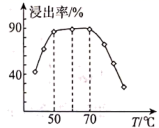
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
| pH(开始沉淀) | pH(完全沉淀) | |
| Fe3+ | 1.52 | 3.18 |
| Mg2+ | 8.10 | 9.43 |
请回答下列问题:
回答下列问题:

该反应分两步进行:
第一步:Co+(s)+N2O(g) CoO+(s)+N2(g) △H1=+15.9kJ•mol-1;
笫二步:;△H2=;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为。
|
容器 |
反应物投入的量 |
平衡时 n(N2/mol) |
达到平衡所需时间/min |
平衡时能量变化/kJ |
|
甲 |
1molCO和1molN2O |
n1 |
t1 |
放热Q1 |
|
乙 |
2molCO和2molN2O |
n2 |
t2 |
放热Q2 |
|
丙 |
2molCO2和2molN2 |
n3 |
t3 |
吸热Q3 |
①Q1+ 358.6(填“>”“=”或“<”下同,t1t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
|
t/s |
0 |
20 |
40 |
60 |
80 |
120 |
|
|
乙 |
x(N2O) |
0.5 |
0.32 |
0.20 |
0.12 |
0.088 |
0.07 |
|
丙 |
x(N2O) |
0 |
0.030 |
0.048 |
0.059 |
0.065 |
0.07 |
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=;该反应的平衡常数K数值为:;(保留3位有效数字)
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置。



铜原子的第一电离能为kJ•mol-1;Cl-Cl键键能为kJ•mol-1;CuCl的晶格能为kJ•mol-1。

①青霉胺分子中S原子的轨道杂化类型为;
②硫化氢与氨气键角的大小:H2SNH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有(用元素符号表示)。
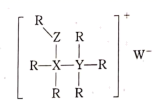
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:。
①离子化合物M的化学式为;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积;
③若晶胞参数为anm,则这种晶体密度为g•cm-3(用含a、和NA的式子表示)。


已知:I.烃A的相对分子量为42;
II.R-CH=CH2 ![]() R-CHO+HCHO:
R-CHO+HCHO:
III.R-Cl+2Na+Cl-R'→R-R'+2NaCl
IV.已知C=C-OH不稳定,原子会发生重排,例: 
回答下列问题:
 与NaOH反应的化学方程式为。
与NaOH反应的化学方程式为。