 称量
B .
称量
B . 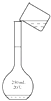 转移
D .
转移
D . | 选项 | 目的 | 实验 |
| A | 除去碳酸氢钠固体中的碳酸钠 | 将固体加热至恒重 |
| B | 制备少量二氧化硫气体 | 向亚硫酸钠固体中加入少量浓硫酸 |
| C | 鉴别溴化钠和碘化钾溶液 | 分别加新制氯水后,用CCl4萃取 |
| D | 比较水和乙醇中氢的活性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |






①金属锂在电极(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是。

①写出H2O2溶液在Fe3+催化下分解的化学方程式;除了图中所示仪器之外,该实验还必需的仪器是。
②请写出下面表格中I、II、III的实验记录内容或数据:
| 实验序号 | 0.1mol/LFe2(SO4)3溶液的体积/mL | II | 30%H2O2溶液的体积/mL | 蒸馏水的体积/mL | O2的体积/mL |
| 1 | I | b | c | d | e |
| 2 | a | b | d | III | f |
I=,II=,III=。



①FeSO4溶液盛放在(填“酸式”或“碱式”)滴定管中。
②该产品中CeO2的质量分数为。

积碳反应:CH4(g)=C(s)+2H2(g) △H=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g) △H=+172kJ·mol-1
回答下列问题:

①由图可知:压强p12MPa(填“大于”、“小于”或“等于”)。
②当温度为T3、压强为2MPa时,A点的v正v逆(填“大于”、“小于”或“等于”)。
③起始时向容器中加入1mol CH4和1mol CO2 , 根据图中点B(T4 , 0.5),计算该温度时反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2),pb(CO2),pc(CO2)从大到小的顺序为。

②(填“增大”或“减小”)投料比 有助于减少积碳。