




 B .
B .  C .
C .  D .
D . 

| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
②
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
| T/℃ | 400 | 300 |
| 平衡常数K | K1 | K2 |
①试判断K1K2(填写“>”“=”或“<”)。
②下列各项能说明该反应已达到平衡状态的是(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是(填字母)。
a.采用较高温度(400~500℃) b.将生成的氨液化并及时从体系中分离出来
c.用铁触媒加快化学反应速率 d.采用较高压强(20~50MPa)


①滴定前排气泡时,应选择下图中的(填序号)。

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)。
A.=10mL B.=40mL C.<10mL D.>40mL
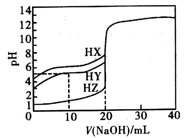
常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=mol•L-1
②X点时,溶液中各离子浓度由大到小的顺序是。
③K点时,溶液中c(H+)+c(M+)–c(OH-)=mol•L-1