①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出氢离子的化合物都是酸
③根据水溶液是否导电,将物质分为电解质与非电解质
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据氧化物中是否含有金属元素,可将分为碱性氧化物和酸性氧化物
| 序号 | 实验操作、现象 | 结论 |
| A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有 |
| B | 向一种未知溶液中滴加盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 未知溶液中一定含有 |
| C | 未知溶液进行焰色试验,焰色为黄色 | 该未知溶液中含钠元素 |
| D | 向紫色石蕊溶液中滴加氯水,溶液先变红后褪色 | Cl2具有酸性和漂白性 |


①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:I.溶液温度升高;II.(填字母序号)。
a.滴入酚酞后呈浅红色 b.滴入酚酞后呈红色
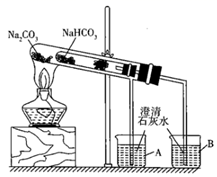
①整个实验过程中,能观察到烧杯B中的现象是;
②实验结束时的操作是。
③写出实验过程中试管中发生反应的化学方程式:。
④该实验可证明NaHCO3的热稳定性(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?(填“能”或“不能”)。
⑤能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是。

A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.两支试管中均盛有3mL6mol/L稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
⑥下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是。
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体

a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于 ⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,15.8g KMnO4能和 gHCl发生上述反应、其中有molHCl被氧化、产生的Cl2在标准状况下的体积为L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为;
①浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:;(已知酸性:H2CO3
>HClO> )
②某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,写出该反应的化学方程式:;