 B .
B .  C .
C .  D .
D . 
| 选项 | 现象 | 结论 |
| A | 带火星木条不复燃 | 呼出气体中不含氧气 |
| B | 冷的干燥玻璃片上有水雾 | 呼出气体中水含量高 |
| C | 澄清石灰水变浑浊 | 呼出气体中二氧化碳含量高 |
| D | 收集时集气瓶正放 | 呼出气体的密度比空气大 |
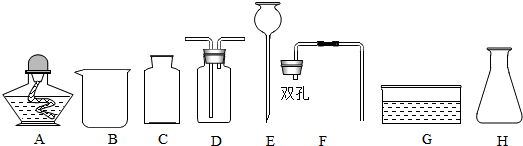
 点燃酒精灯
B .
点燃酒精灯
B .  固体药品加热
C .
固体药品加热
C .  验证氢气密度
D .
验证氢气密度
D .  取用液体
取用液体
| 选项 | 实验事实 | 实验结论 |
| A | 电解水生成氢气和氧气 | 水由氢气和氧气组成 |
| B | 某物质可以导电 | 该物质一定是金属单质 |
| C | 纸张燃烧后余烬的质量比原纸张的质量小 | 该反应仍然遵守质量守恒定律 |
| D | 铁在潮湿的空气中易生锈 | 只要有水,铁制品就会生锈 |



| A.除杂的方法 | B.化学物质中的“三” |
| 除去氧化铜中的碳粉—在空气中灼烧 除去CO中的CO2—通过澄清石灰水 CO2中混有CO—点燃 | 三大化石燃料—煤、天然气。石油 构成物质的三大粒子—分子、原子、离子 三种黑色氧化物—CuO、MnO2、Fe3O4 |
| C.实验安全注意事项 | D.化学物质与俗名 |
| 制取气体—先检查气密性 点燃可燃气体—先验纯 进入久未开启的菜窖—先用“灯火试验” | 固体二氧化碳—干冰 氧化钙—生石灰 硫—硫磺 |


物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 10 | 16 | 0 | 0 |
反应中质量(g) | m2 | 1.6 | ||
反应后质量(g) | m1 | 0 | 15.2 | 6.4 |
| 装置(夹持仪器已略去) | 步骤及现象 |
| | Ⅰ.将一定量的白磷、红磷分别浸入80℃热水中,白磷、红磷均不燃烧; Ⅱ.升高右侧漏斗至红磷露出水面,红磷不燃烧; Ⅲ.升高左侧漏斗至白磷露出水面,白磷燃烧。 |

目前,天然气是一种关键的能源,但它在储存或运输时存在危险。它通常会被转化为液态,以使其更容易操作。然而,这需要极低的温度,大约在零下162℃。
一种新出现的方法是将天然气转化为固体,以便于运输和储存。事实上,自然界在某些条件下已经做到了这一点,因为天然气分子会被困在水分子的“笼子”里,形成所谓的天然气水合物或可燃冰。不过这远不是一个快速的过程,需要数百万年以上的时间。
近日,科学家开发新方法可快速将天然气转化为固体形式进行储存。新混合物的关键成分是L-色氨酸,这是一种氨基酸,可以加快反应速度,并更快地将更多的气体捕获到固体水合物中。
最终产品的存储和运输更加方便和安全。作为一块冰块,它的体积只有此前的1/90,而且不爆炸,稳定性好,可以储存在零下5℃的普通冰柜中。
A天然气转化为固体后,其中分子停止运动
B可燃冰中甲烷分子和水分子间存在间隔
C天然气转化为固体新方法更高效、环保
将打磨过的铝片放入硫酸铜溶液中,看到的现象之一是,说明铝的金属活动性比铜(填“强”或“弱”),写出反应的化学方程式。
①小明将铝粉加入到盛有冷水的试管中,加热至沸腾,没有观察到明显的现象。但先将水煮沸后再加入铝粉产生了少量白色沉淀。依据气体的溶解度随温度的升高而减小的性质,小明认为在冷水中加入铝粉后进行加热,没有明显现象的原因是。
②将铝粉加入到盛有冷水的试管中,加热至沸腾,滴入几滴氯化钠溶液,观察到有少量白色沉淀产生。为什么滴入氯化钠溶液后铝就能和水发生反应了?
猜想2:。
|
实验操作 |
实验现象和结论 |
|
|
|
假设:反应产生的气体可能全部为二氧化碳或一氧化碳,也可能两种气体都有。
查阅资料:新鲜的鸡血加入抗凝剂后再用水稀释,此鸡血遇氧气呈鲜红色,遇二氧化碳呈暗红色,遇一氧化碳呈胭脂红。
设计实验:小明将一定量的氧化铁在隔绝氧气的条件下与碳粉反应,实验装置如图1(他在实验中进行了规范操作和细致的观察)。


实验操作步骤及现象如下:
①称取3.2克氧化铁与2克炭粉均匀混合,放入重48.48克的玻璃管中,按上图装置连接;
②通一段时间纯净、干燥的氮气;
③夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24克。
⑤数据处理。根据小明的实验结果,请你帮他计算参加反应的氧元素的质量是克,碳元素的质量是克。小明通过此实验得出的结论是。此实验中第②步操作的目的是。
|
次数 |
第一次 |
第二次 |
第三次 |
|
加入稀硫酸质量/g |
5 |
5 |
5 |
|
生成氢气质量/g |
0.02 |
0.02 |
0.01 |
请计算:

①由图可知:生成CO2气体的质量为g。
②计算反应后固体混合物中FeO的质量分数 (请根据化学方程式写出完整的计算步骤)。