 B . 过滤泥浆水
B . 过滤泥浆水  C . 水的电解
C . 水的电解  D . 食物霉变
D . 食物霉变 
| 物质 | 西红柿 | 柠檬汁 | 鸡蛋清 | 纯水 | 漂白液 |
| pH | 4 ~5 | 2 ~3 | 7 ~8 | 7 | 13 ~ 14 |
上述物质中,酸性最强的是( )
 B .
B .  C .
C .  D .
D . 








⑴将固体混合物放入足量的水中,产生白色沉淀和生成透明溶液.
⑵再加入足量的稀硝酸,沉淀全部溶解,产生无色气体,溶液澄清透明.
⑶最后加入稀硫酸,溶液又立刻出现白色沉淀.

①从市场上购买了三种不同产地的茶叶,编号为A、B、C。
②取取A、B、C三种茶叶分别在相同的条件下,用开水冲泡。
③用用pH试纸分别到杯中蘸取A、B、C三种茶叶的泡出液,和标准比色卡比对,测得它们的pH分别为5.4、6.3、6.0。
④将形状、大小、质量相同的脂肪小块,分别放入盛有三种茶叶泡出液的相同杯中,在适宜的温度下保温55小时后,分别滤出脂肪块,吸干表面水分并称量。根据脂肪块在茶水中浸泡前后的质量变化(不考虑脂肪块吸水),判定茶水能否溶解脂肪。
请回答下列问题:

入稀盐酸一会后,发现忘记了滴加指示剂.因此,对烧杯内溶液中的溶质成分进行探究。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和和Ca(OH)2;猜想二:可能只有CaCl2;
猜想三:可能是CaCl2和和HCl。
【查阅资料】氯化钙溶液呈中性 。
【进行实验】实验步骤1 :取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 。
实验现象: ,结论:猜想一不正确。
实验步骤2:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象: ,结论:猜想二不正确,猜想三正确。
【反思与拓展】验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)
A.pH试纸B.铜C.紫色石蕊溶液D.硝酸银溶液

①盐酸是氯化氢气体溶于水形成的溶液,在盐酸中存在氢离子、氯离子和水分子。
②氯化氢气体也可溶于甲苯(一种有机溶剂),氯化氢的甲苯溶液中氯化氢以分子的
形式存在。
③盐酸与氯化氢的甲苯溶液的微观示意图如图1所示。
④紫色石蕊加入盐酸溶液变红,紫色石蕊加入氯化氢的甲苯溶液无明显现象。
请回答下列问题:



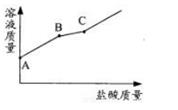
过程中溶液质量随加入 稀 盐酸质量而变化的情况 。 请结合图像判断该氢氧化钠溶液的是否全部变质?并说明理由。

①去掉装置A,将空气直接鼓入装置B
②当气泡停止产生时立即停止鼓入空气
③去掉装置C,将B与与D装置直接相连
|
加入NaOH 溶液的质量/g |
40.0 |
80.0 |
120.0 |
160.0 |
200.0 |
|
生成沉淀的质量/g |
0.0 |
2.45 |
7.35 |
9.8 |
9.8 |