

已知: 和
均为能溶于水的强电解质。下列说法正确的是( )

| 选项 | 实验 | 现象 | 结论 |
| A | 将大小相同的金属钠分别投入水和乙醇中 | 钠与水反应比钠与乙醇反应剧烈 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| B | 向盛有无色溶液的试管中滴加足量浓NaOH溶液并加热,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
| C | 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为 |
| D | 向蔗糖中加入浓硫酸并搅拌 | 蔗糖变黑,体积膨胀,有刺激性气味的气体生成 | 反应中浓硫酸体现了强氧化性和脱水性 |
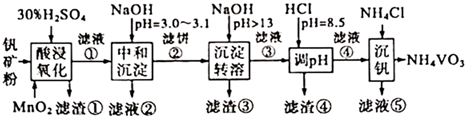
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | | | | | |
| 开始沉淀pH | 1.9 | 7.0 | 8.9 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 10.9 | 4.7 | 10.1 |
下列说法错误的是( )
 回答下列问题:
回答下列问题:
a.氯化钡溶液 b.稀硫酸酸化的KMnO4溶液时 c.碘水和淀粉的混合溶液 d.NaOH溶液

回答下列问题:。
实验室制备氨气的发生装置,可以选择如图装置中的(填序号)。
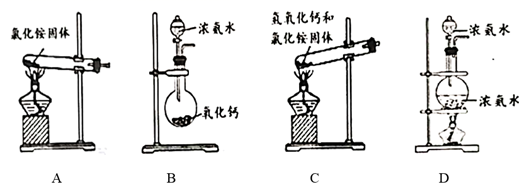

①Z中盛有(填名称);打开 ,关闭
,
能够被
还原,预期观察到Y装置中的现象是。
②氨气与NOx反应的化学方程式为。
电解氧化吸收法可将废气中的 转变为硝态氮。分别向0.1
NaCl溶液和0.08
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解0.1
NaCl溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。

①电解 溶液时产生
。
氧化吸收NO的离子方程式为。
②电解NaCl溶液时,当电流强度大于4A后,NO去除率下降的原因是。

已知:
①
,合适的反应温度为18℃~25℃;副反应:
。
②常压下, 的沸点2.0℃,熔点-120.6℃;常温下会缓慢分解;与氧气混合物的爆炸极限为25%。
③ 能与水反应,
在
中的溶解度远大于在水中的溶解度。
回答下列问题: