 称量NaOH固体
B .
称量NaOH固体
B .  配制NaOH溶液
C .
配制NaOH溶液
C .  稀释浓H2SO4
D .
稀释浓H2SO4
D .  测稀H2SO4的pH
测稀H2SO4的pH
选项 | 性质 | 用途 |
A | 氢氧化钙呈碱性 | 改良酸性土壤 |
B | 浓硫酸具有脱水性 | 干燥氧气 |
C | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |
| 序号 | 实验目的 | 实验方案 |
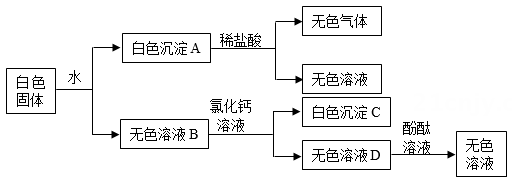
| A | 证明变质 | 取少量固体,加水溶解,滴加少量稀盐酸,观察是否有气泡产生 |
| B | 确定成分 | 取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液 |
| C | 测定纯度 | 取ag样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到mg固体 |
| D | 除去杂质 | 取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤 |
|
A |
B |
C |
D |
|
向稀硫酸中加入过量的锌,溶液中溶质质量 |
向pH=2的盐酸中滴加过量的氢氧化钠溶液 |
向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液 |
向pH=12的氢氧化钠溶液中加水稀释 |
|
|
|
|
|
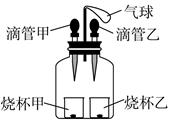
| 选项 | 滴管甲 | 烧杯甲 | 滴管乙 | 烧杯乙 |
| A | 水 | 氧化钙 | 稀盐酸 | 镁 |
| B | 稀盐酸 | 铁 | 盐酸 | 碳酸钠 |
| C | 双氧水 | 二氧化锰 | 水 | 氢氧化钠 |
| D | 水 | 碳酸钠 | 盐酸 | 氢氧化钠 |
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 铁锈 | KNO3粉末 | 加入足量水,过滤 |
| B | CO2气体 | CO | 通入氢氧化钠溶液 |
| C | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| D | NaCl溶液 | BaCl2 | 加入适量硫酸钾,充分反应,过滤 |

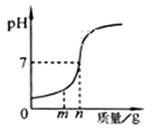
如图表示的是一些物质在常温下的近似pH,回答下列问题:

①酸雨的酸性比正常雨水的酸性(填“强”或“弱”)
②测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏(“大”或“小”)


|
实验步骤 |
实验现象 |
实验结论 |
|
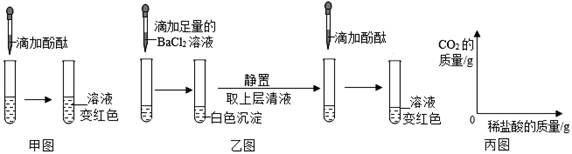
向滴有酚酞溶液的稀氢氧化钠溶液的试管中,逐滴加入稀盐酸,并振荡。 |
观察到溶液由 色变为无色。 |
氢氧化钠和盐酸发生了反应。 |
猜想一:只有NaCl;
猜想二:有NaCl和NaOH;
猜想三:有NaCl和HCl;
经过讨论后认为猜想二不合理,理由是。
|
实验步骤 |
实验现象 |
实验结论 |
|
取(1)实验后溶液少量于试管中,加入药品。 |
没有明显现象 |
猜想一是正确 |

【演示实验】老师按如图所示连接好装置,加入NaHCO3粉末,点燃酒精灯,对试管预热后集中加热,烧杯中澄清石灰水变浑浊,说明生成了CO2。继续加热至无气体产生后撤出导管,熄灭酒精灯。
【问题提出】实验后,同学们对试管中剩余的固体粉末产生了兴趣:剩余粉末由什么物质组成?
【猜想假设】在老师的指导下,同学们对固体粉末作出了如下猜想:
猜想一:NaOH; 猜想二:NaOH和Na2CO3; 猜想三:Na2CO3。
【实验探究】
| 实验方案 | 实验操作 | 实验现象 |
| 方案一 | 取适量粉末溶于水后向溶液中滴入2滴酚酞溶液,摇匀 | 溶液由无色变红色 |
小明根据实验现象认为猜想一成立。小组讨论后,大家认为小明的结论不合理,于是设计了如下的方案二:
| 实验方案 | 实验操作 | 实验现象 | 实验结论 | |
| 方案二 | 步骤一 | 取适量粉末溶于水后加入过量的BaCl2溶液 |
| 猜想一不成立 |
| 步骤二 | 取步骤一的上层清液加入MgCl2溶液2﹣3mL | 无明显现象 | 猜想三成立 | |
【评价交流】小华认为步骤二也可以用MgSO4代替MgCl2 , 大家不同意他的观点,理由是。
【拓展延伸】请你总结上述实验成果,写出碳酸氢钠受热分解的化学方程式。

①另一个物理量为( 填序号)。
A. 滴下的稀盐酸质量 B.反应前后乙装置增加的质量
C、反应前后丙装置增加的质量 D、反应前后丁装置增加的质量
②若去掉丁装置,测得CaCO3含量(填 “偏高”、“偏低”或“不变" )。


A、图2中b点所示溶液中的溶质是硫酸钾和氢氧化钾
B、图2中c→d所示溶液中硫酸钾的质量不断增加
C、图3中e→f变化趋势可说明该反应是放热反应
D、整个过程烧杯中水的质量一直增加且快慢一样


【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】取一定量上述固体粉末,加足量水溶解。

①计算产生最大沉淀量时所加NaOH溶液的质量。
②通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)