| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | H2O |
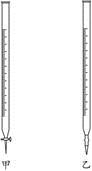
| 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |


①在外电路中,电子由铜电极流向银电极
②正极反应:Ag++e−=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同


①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高

已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:


实验过程如图所示,分析判断:段化学反应速率最快。由该段图象说明:此反应属于(填“吸热”或“放热”)反应。

若Z和X为气体,则Y为体(填气或非气)。


①从实验装置上看,图中尚缺少的一种玻璃用品是。
②烧杯间填满碎纸条的作用是。
③大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”“偏小”或“无影响”)。
某学校化学课外小组用0.2000mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,选择甲基橙作指示剂,试回答下列问题。
①滴定过程中,眼睛应注视。
②滴定终点时的现象:。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是mol·L-1.(保留四位有效数字)
|
滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
|
滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果。
b.若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果。