
| 选项 | 甲中溶液 | 乙中药品 | 丙中物质 |
| A | 稀盐酸 | 二氧化锰 | 饱和食盐水 |
| B | 浓硝酸 | 亚硫酸钠 | 饱和亚硫酸氢钠溶液 |
| C | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | 浓氨水 | 碱石灰 | 浓硫酸 |
| 选项 | 实验操作 | 实验目的 |
| A | 淀粉溶液加稀硫酸共热后,加入新制氢氧化铜悬浊液,加热 | 检验淀粉是否水解 |
| B | 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的KMnO4溶液 | 依据褪色时间来研究浓度对反应速率的影响 |
| C | H2(g)+I2(g) | 通过颜色深浅变化研究压强对平衡移动的影响 |
| D | 向某溶液中加入氢氧化钠固体,加热,将湿润的红色石蕊试纸置于试管口 | 检验溶液中是否含有铵根离子 |
 )是合成某种手性药物的中间体。有关该化合物,下列叙述错误的是( )
)是合成某种手性药物的中间体。有关该化合物,下列叙述错误的是( )

已知:ClO2常温下为黄绿色气体,11℃时液化成红棕色液体,易溶于水,ClO2溶于碱溶液生成亚氯酸盐和氯酸盐。
下列说法错误的是( )




已知N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1 , 则表示CO燃烧热的热化学方程式为。
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/×10-3mol•L-1 |
1.00 |
0.45 |
0.25 |
0.15 |
0.10 |
0.10 |
|
c(CO)/×10-3mol•L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
①0~2s内用N2表示的化学反应速率为。该温度下,CO的平衡转化率为。
②实验测得,该反应的反应历程如图,其中活化能相对较大的是第步(填“一”或“二”)。
第一步:  +C—O→
+C—O→  (慢反应)
(慢反应)
第二步:  →N—O+C—O—C(快反应)
→N—O+C—O—C(快反应)

在 =1条件下,选择温度控制在870K的理由是。
|
P(CO)/kPa v/kPa•s-1 P(NO2)/kPa |
10 |
20 |
30 |
|
10 |
0.009 |
0.018 |
0.027 |
|
20 |
0.018 |
0.036 |
0.054 |
|
30 |
0.027 |
0.054 |
0.081 |
若反应初始时p(CO)=p(NO2)akPa,达到平衡,测得体系中p(NO)=bkPa,则此时v=kPa•s-1(用含有a和b的代数式表示)。
一定温度下,向一固定体积的密闭容器中充入CO、CO2和H2来制备甲醇。测得在不同温度下的化学反应平衡常数如表所示:
|
化学反应 |
平衡常数 |
温度/℃ |
||
|
500 |
700 |
800 |
||
|
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g) | K3 | |||
反应②中的△H=0(填“大于”或“小于”),K3=(用K1、K2表示)

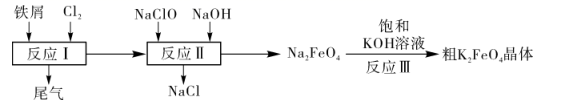
某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2 , 在碱性溶液中较稳定。
a.  b.
b. 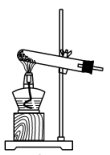
c. 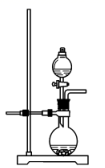 d.
d. 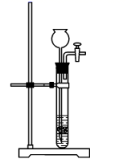
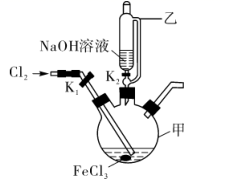

已知:①反应2的化学方程式为Na2SiF6+4NH3·H2O=2NaF+4NH4F+SiO2↓+2H2O。
②冰晶石(Na3AlF6)微溶于水。
回答下列问题:

A.  B.
B. ![]()
C. ![]() D.
D. 
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为(填元素符号)。
①(H2NCH2COO)2Fe中含有第二周期元素的第一电离能由大到小的顺序为(用元素符号表示),碳原子的杂化类型为。
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃大很多,原因是。
①晶胞中铁原子的配位数为。
②图中a处原子的坐标参数为,合金的密度为g•cm-3。


已知:①RX+Mg RMgX(X=Cl、Br、I)
②RMgBr+CO2→RCOOH
③RMgBr+R'CHO

回答下列问题:
①除苯环外无其他环
②能发生银镜反应
③核磁共振氢谱为4组峰,峰面积比为9∶2∶2∶1
 的合成路线: (其他试剂任选)。
的合成路线: (其他试剂任选)。