B . 防弹头盔
B . 防弹头盔  C . 半导体集成电路
C . 半导体集成电路  D . 光导纤维
D . 光导纤维 
 B . 烧菜铁锅
B . 烧菜铁锅  C . 导线铜丝
C . 导线铜丝  D . 玻璃茶壶
D . 玻璃茶壶 
 B . 葡萄pH=5.1
B . 葡萄pH=5.1  C . 猕猴桃pH=3.3
C . 猕猴桃pH=3.3  D . 桔子pH=3.6
D . 桔子pH=3.6 
 B . 水挥发
B . 水挥发  C . 水果腐烂
C . 水果腐烂  D . 冰块融化
D . 冰块融化 
 B . 滴加液体
B . 滴加液体  C . 倾倒液体
C . 倾倒液体  D . 稀释浓硫酸
D . 稀释浓硫酸 
 B .
B .  C .
C .  D .
D . 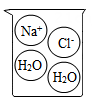
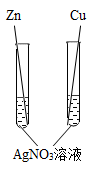 B .
B . 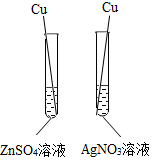 C .
C . 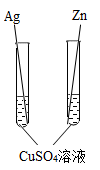 D .
D . 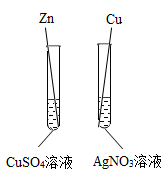
| 含氮 | 含磷 | 含钾 | |
| 土壤肥量标准(g/kg) | 0.62 | 0.34 | 17.8 |
| 测定结果(g/kg) | 0.4 | 0.38 | 13.6 |

 B .
B .  C .
C .  D .
D . 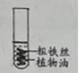
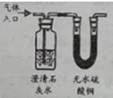 B .
B . 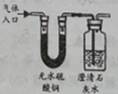 C .
C . 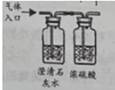 D .
D . 

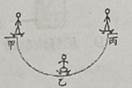 B .
B .  C .
C .  D .
D . 

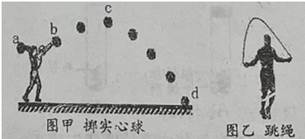
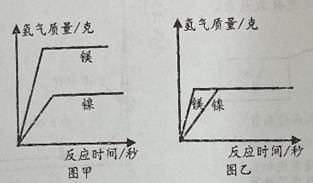
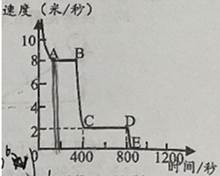
①该同学对实心球有做功的阶段是(填“ab”、“bc”或“cd”)。
②经过最高点c点时,实心球的动能0(填“>”、“=”或“<”)。
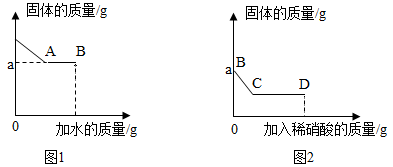
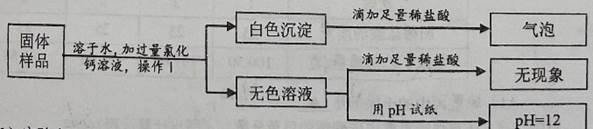
①取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图甲所示;
②静置片刻后,往烧杯中滴加酚酞溶液,上层清液不变色;
③继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体的质量随加入稀盐酸质量的变化如图乙所示。
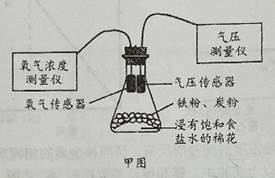
①连接实验仪器并进行气密性检查;
②称取一定量铁粉和2.0克活性炭,在研钵内混合均匀待用,将浸有饱和食盐水的棉花平铺在锥形瓶底部;
③用纸槽将取出的铁粉和活性炭粉快速均匀平铺在棉花上,迅速把带有氧气传感器的单孔橡皮塞旋紧,如图甲所示;
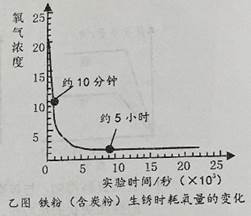
④多次测量,绘制氧气浓度的变化曲线,如图乙所示,得到气压测量仪器上的数据,发现气压先上升后下降,手触摸锥形瓶外壁,有明显的发热现象;
⑤将铁粉换成是等量的粗铁丝,重复上述实验,刚开始无明显现象,几天后粗铁丝表面红色物质明显增多,氧气浓度不断下降。
【查阅资料】采用活性炭可使铁粉疏松、透气;饱和食盐水可促进耗氧反应。
结合上述过程,完成下列问题:
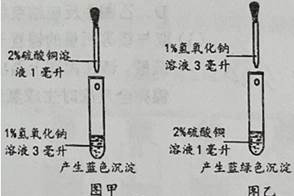
查阅资料发现:
①在碱性条件下,硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜;
②在酸性条件下,硫酸铜溶液和氢氧化钠溶液反应生成碱式硫酸铜【Cu4(OH)6SO4】;
③碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸,与盐酸反应的化学方程式为:Cu4(OH)6SO4+6HCl = CuSO4 + 3CuCl2 + 6H2O;
|
步骤 |
主要实验操作 |
实验现象 |
|
① |
取乙组实验后的混合物过滤 |
得到蓝绿色沉淀 |
|
② |
取蓝绿色沉淀,用蒸馏水洗涤几次 |
无明显现象 |
|
③ |
向最后一次洗涤液中滴加氯化钡溶液 |
|
|
④ |
取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 |
沉淀全部溶解,得到蓝绿色溶液 |
|
⑤ |
取少量蓝绿色溶液于试管中,滴加氯化钡溶液 |
产生白色沉淀 |
|
实验结论:蓝绿色沉淀是碱式硫酸铜 |
||
完成步骤③实验现象。
实验室提供的材料:带塞子的试管(如图所示)若干支、变色硅胶(柱状颗粒,吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)、一瓶密封的氢氧化钠固体(取少部分固体于玻璃皿中)、镊子若干、药匙若干。
资料一:氯化铜溶液中的Cu2+会与H2O、Cl-相结合,分别形成呈蓝色物质1和呈黄色物质2。Cu2+与H2O、Cl-相结合的数量会随着氯化铜溶液浓度的改变而发生变化,从而使呈蓝色物质1和黄色物质2的数量发生变化。
资料二:根据光学原理,颜色可调。例如:蓝色+黄色=绿色。
请解释原因:
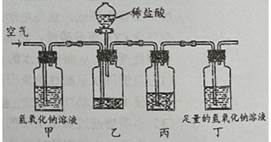
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
| 装置丁的总质量/g | 100.50 | 101.08 | 101.66 | 101.68 |