 B .
B .  C .
C .  D .
D . 
| 物质 | N | Q | R | |
| 分子示意图 | | | |
| 物质 | M | N | Q | P |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | X | 26 | 2 | 12 |
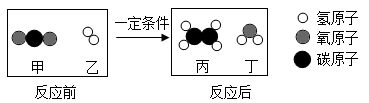
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 40 | 3 | 10 | 15 |
反应t时刻的质量/g | 23 | 19 | a | |
反应后的质量/g | x | y | 28 | 31 |

|
2个氢分子 |
碳酸钠 |
|
|
锌原子 |
|
|
符号 |
|
|
Fe2O3 |
3Cl- |
|

A水、氢气 B铁、氧气 C氯化钠、铜 D氯化钠、水
第一组:H2、Al,分类依据是 ;第二组: ,分类依据是都属于氧化物;第三组: ,分类依据是都属于混合物。

①决定元素种类的是 。
②表中具有相对稳定结构的原子是 。
③铝离子符号为 。
④上述元素在周期表中处于同一周期的原因是 。
![]()
该反应的化学方程式为 。

①a的化学式是(举一例),b、c粒子的名称依次是。
②构成氯化钠的粒子是(填粒子符号)。

①图乙中D若为原子,则X=,其属于(填“金属元素”、“非金属元素”或“稀有气体元素”)。
②图乙中B、C属于同种元素,因为它们的相同。
③由A、B形成的化合物中,A、B元素的原子数目比为。

①图示物质中属于氧化物的有(填字母)。
②该反应的化学方程式为。
A 原子种类
B 原子数目
C 分子种类
D 分子数目
E 元素种类
F 元素质量
G 物质种类
H 物质的总质量
①镁条燃烧的化学方程式为,现象为。
②理论上m1应小于m2 , 请运用质量守恒定律进行解释:。
③若实际称得的m1大于m2 , 可能的原因是。

|
气体 |
吸入气体 |
呼出气体 |
|
X |
77.95% |
74.58% |
|
Y |
21.02% |
15.16% |
|
CO2 |
0.04% |
3.28% |
|
H2O |
0.06% |
6.06% |

(经典赏析)法国科学家用图1装置测出空气中O2的体积分数约为20%,其反应化学方程式为,该实验选择汞的优点有(填字母)。
A汞常温下呈液态,便于形成液封
B反应生成的氧化汞是固态,几乎不影响装置内气体压强
C加热时汞只与氧气反应,不与其他气体反应
D汞的沸点较低,易形成蒸气,能将密闭装置内空气中的氧气几乎耗尽

①X曲线表示压强变化趋势,Y曲线表示(填“温度”或“氧气浓度”)变化趋势。
②结合Y、Z两条曲线综合分析,图4中AB段压强变化的原因是;CD段变化的原因。
(实验1)按图1所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
(实验2)按图2所示装置,用蜡烛燃烧的方法测定空气中氧气的体积分数。
(实验3)按图3所示装置,在集气瓶内壁用水均匀涂某除氧剂,利用除氧剂和氧气反应的原理测定空气中氧气的体积分数。

资料1:二氧化碳因与氢氧化钠溶液发生化学反应生成碳酸钠和水,实验室常用氢氧化钠溶液来吸收二氧化碳。
资料2:蜡烛在密闭的集气瓶中燃烧,氧气浓度不断变小的同时,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与氢氧化钠溶液反应。
(交流与讨论)根据以上信息回答下列问题:
有同学提议实验2中在集气瓶底部预先放少量氢氧化钠溶液吸收生成的二氧化碳气体,实验就能成功。该反应的化学方程式为:。但小华觉得不可行,其主要原因是。



A节约药品用量B能完全消除废物的排放
C能控制液体的滴加速度D产生的气体不含任何杂质