


①CO (aq)+H+(aq)⇌HCO
(aq) ΔH1
②HCO (aq)+H+(aq)⇌H2CO3(aq) ΔH2
③H2CO3(aq)⇌H2O(l)+CO2(g) ΔH3


下列说法中正确的是( )
| 方案设计 | 现象 | 结论 | |
| A | 用pH试纸测定NaCl与NaF溶液的pH | 前者小于后者 | F元素的非金属性强于Cl |
| B | 压缩装有HI、I2、H2混合气体(已达平衡)的容器 | 颜色加深 | 平衡向生成I2的方向移动 |
| C | 用pH试纸测量饱和新制氯水的pH | pH试纸变为红色 | 饱和新制氯水呈酸性 |
| D | 向酸性KMnO4和H2C2O4的混合液中加入一小块MnSO4 | 生成气体(CO2)的速率加快,溶液迅速褪色 | MnSO4是该反应的催化剂 |
|
弱酸 |
HCOOH |
| HClO | |
| 电离平衡常数/25℃ | | | | |
①在相同条件下,试比较 、
和
的酸性从强到弱顺序为。
②将少量 气体通入NaClO溶液中,写出该反应离子方程式。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/( | 414 | 489 | 565 | 155 |

①若将杯盖改为薄铁板,求得的反应热 将(填“偏大”、“偏小”或“无影响”)。
②实验时玻璃搅拌器的运动方向是。
a.上下运动b.左右运动c.顺时针运动d.逆时针运动
③若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:。

i.
ii.
①则总反应的 kJ/mol;该反应应选择高效催化剂(填“高温”或“低温”)。
②上述总反应在容积不变的密闭容器进行,在 时达到平衡,当其他条件不变时,改变某一条件,关于下列图像的描述,说法错误的是。

A.图甲表示 时升高温度对反应速率的影响
B.图乙表示 时加压或催化剂对反应速率的影响
C.图丙表示 时分离出甲醇对反应速率的影响
D.图丙表示 时增加水蒸气的物质的量对反应速率的影响
① ℃时,该反应的平衡常数
(对于气相反应,用某组分B的平衡压强
代替物质的量浓度
也可表示平衡常数,记作
,如
,p为平衡总压强,
为平衡体系中B的物质的量分数)。

②其他条件不变,仅改变某一条件后,测得 的物质的量随时间变化如图状态II、状态III所示。则状态III改变的条件可能是。
③上述反应(状态I)达到平衡后,保持其他条件不变,在 时刻迅速将容器体积压缩至1L,请在图2中画出
时刻后
的变化趋势图。

①图中对应等压过程的曲线是,判断理由是。
②当 时,
平衡转化率α=(保留一位小数)。
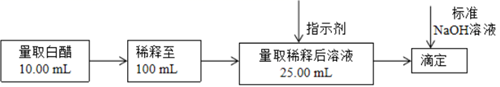

|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00mL |
0.02 |
25.01 |
|
2 |
25.00mL |
0.70 |
25.71 |
|
3 |
25.00mL |
0.50 |
24.2 |
则该白醋(填“符合”或“不符合”)国家标准。