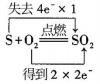
 B .
B . 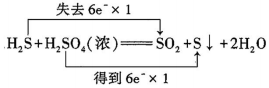 C .
C . 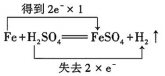 D .
D . 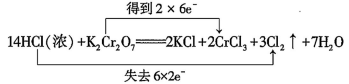
①根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 ②根据氧化物中是否含有金属元素,将氧化物分为酸性氧化物和碱性氧化物 ③根据酸分子能电离出的氢离子个数将酸分为一元酸、二元酸等④根据物质在水溶液里或熔融状态下能否导电,将化合物分为电解质和非电解质


|
盐酸 分子式: HCl 相对分子质量: 36.5 密度: 1.19g/mL 质量分数: 36.5% |
a.10mL b.15mL c.25mL d.0mL
A.用量筒量取所需体积的浓盐酸,将其沿玻璃棒缓缓注入烧杯中,再向烧杯中加入少量蒸馏水,用玻璃棒慢慢搅动
B.将已恢复至室温的稀盐酸小心地用玻璃棒引流入 250mL 容量瓶
C.用约 30mL 蒸馏水洗涤烧杯和玻璃棒 2~3 次,并将洗涤液都注入容量瓶中
D.继续往容量瓶中加蒸馏水,至液面接近刻度线 1~2cm
E.… …
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.将配制好的稀盐酸倒入试剂瓶,贴上标签
步骤 E 为。
a.量筒量取浓盐酸读数时俯视
b.未等恢复至室温就转移
c.向容量瓶转移时,不慎将少量溶液洒到容量瓶外面
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
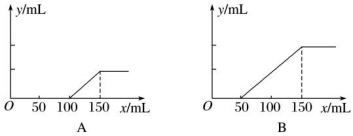
在 A 情况下,溶质是(填化学式) ,其物质的量之比为。


在明显的缺陷,请提出合理的改进方法: 。