 收集CO2
B .
收集CO2
B . 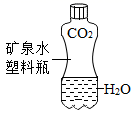 振荡后塑料瓶变瘪
C .
振荡后塑料瓶变瘪
C . 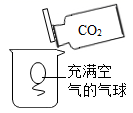 气球上浮
D .
气球上浮
D . 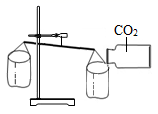 倒入CO2的纸袋下沉
倒入CO2的纸袋下沉
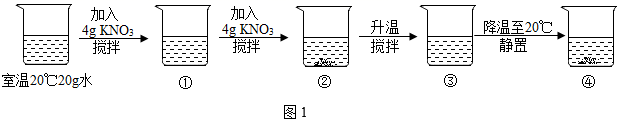
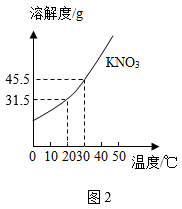
①加入CaO ②加入Ca(OH)2③升高温度 ④降低温度.

物质(纯净物) | 酒精 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4.0 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
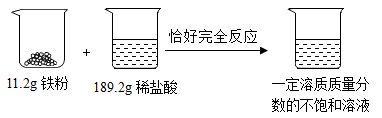
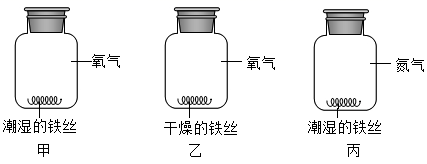
 将铁粉加入到一定量的稀盐酸中
B .
将铁粉加入到一定量的稀盐酸中
B .  用一定量的木炭还原氧化铜
C .
用一定量的木炭还原氧化铜
C .  分别向等量的镁、铝中加入等浓度的稀硫酸
D .
分别向等量的镁、铝中加入等浓度的稀硫酸
D .  向盛有MnO2的试管中加入H2O2溶液
向盛有MnO2的试管中加入H2O2溶液
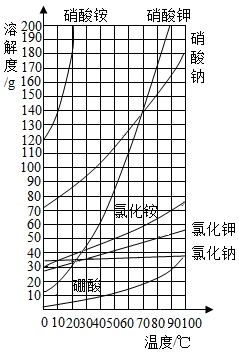



计算:氯化钠质量和水的体积。(ρ水=1.0g/mL)。


上述实验过程中,用量筒量取水时,若按下图方式进行读数,将导致所配溶液的溶质质量分数(选填“偏大”“不变”或“偏小”)。

①量筒 ②漏斗 ③玻璃棒 ④托盘天平 ⑤烧杯

(作出猜想)猜想一:氧气 猜想二:氢气 猜想三:二氧化碳。
(交流讨论)大家思考后一致认为猜想三不合理,其理由是。
(实验验证)验证猜想一:用试管收集该气体,,则猜想一不成立。
(查阅资料)配置硫酸铜溶液时往往加入一定量的稀硫酸。
(结论)产生的气体是氢气。写出产生氢气的化学方程式。
大家一致认为是铜,理由是(用化学方程式表示)。
①甲同学取少量红色固体放在铜片上,在空气中加热,红色固体很快变黑。发生反应的化学方程式是。此实验在铜片上加热红色固体,利用了铜的性质是。
②乙同学向红色固体中加入一种无色液体,红色固体表面很快产生黑色固体,溶液逐渐变蓝色。他加入的液体可能是。
(结论)甲、乙同学的实验证实了红色固体是铜。