 B .
B .  C .
C .  D .
D . 
选项 | 事实 | 解释 |
A | 金刚石的硬度远大于石墨 | 碳原子结构不同 |
B | 蔗糖溶液不能导电 | 溶液中没有自由移动的粒子 |
C | 6000L氧气在加压的情况下可装入容积为40L钢瓶中 | 氧分子变小了 |
D | 稀盐酸、稀硫酸均显酸性 | 溶液中都含有氢离子 |

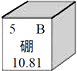
 表示图中处元素的原子结构示意图(填序号),在化学反应中该原子易电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是(填序号)。
表示图中处元素的原子结构示意图(填序号),在化学反应中该原子易电子(填“得到”或“失去”)。下图①、②、④三处元素中,与③处元素属于同一周期的是(填序号)。

①写出该反应的化学方程式。
②在该反应中,化合价升高的元素是(填元素符号,下同),化合价降低的元素是。

①查阅资料知:
②向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中继续加入溶液,观察是否有沉淀生成。
③精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为。
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
质量/g | 92.0 | 91.0 | 90.5 | 90.2 | 90.1 | 90.4 | 90.1 | 90.1 | 90.1 |


问题猜想 | 实验步骤 | 实验现象 | 实验结论 |
原因一:石灰水已完全变质 | 取少量未通入CO2的澄清石灰水于试管中,向试管中滴加溶液。 | (填“有”或“没有”)沉淀生成 | 猜想的原因二正确 |
原因二:产生的CO2中带有HCl气体 | 将盐酸与石灰石反应生成的气体通入溶液中、 | (填“有’或“没有”)沉淀生成 |

①仪器a、仪器b的名称分别是。
②锥形瓶内发生反应的化学方程式是。
方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃—-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守恒角度分析,该鱼腥气味的气体是。

“解离”时,结构被破坏的分子是(填化学式)。
反应条件:6.0mL30%双氧水,0.1g氯化物,室温:实验时间:1.5h。实验数据如表所示。由表可知,双氧水保存时应绝对避免引入的离子是(写离子符号)。
|
氯化物 |
NaCl |
MgCl2 |
CuCl2 |
|
放出氧气的体积/mL |
2.0 |
4.0 |
420.0 |
|
双氧水的分解率/% |
0.30 |
0.60 |
63.18 |
第一次 | 第二次 | 第三次 | 第四次 | |
稀盐酸的用量/g | 5.0 | 5.0 | 5.0 | 5.0 |
剩余固体的质量/g | 1.5 | 1.0 | 0.5 | 0.3 |