选项 | 归类 | 内容 |
A | 反应容器 | 试管、量筒、集气瓶 |
B | 可燃气体 | 氢气、氧气、天然气 |
C | 常见溶液 | 碘酒、液氮、食盐水 |
D | 白色固体 | 氧化镁、碳酸氢铵、五氧化二磷 |
 称量
B .
称量
B .  溶解
C .
溶解
C .  过滤
D .
过滤
D .  蒸发
蒸发

选项 | 物质 | 目的 | 主要实验操作 |
A | CO2和N2 | 鉴别 | 分别通入紫色石蕊试液中,观察现象 |
B | CH4中是否混有H2 | 检验 | 点燃,在火焰上方罩干冷烧杯,观察现象 |
C | CaCl2溶液中混有盐酸 | 除杂 | 加入过量铁粉,充分反应后过滤 |
D | KNO3、NaCl混合固体 | 分离 | 溶解、过滤、洗涤、烘干、蒸发 |



A.活性炭 B.盐酸 C.石灰石 D.镁粉 E.洗洁精F.食盐G.硝酸铵H.武德合金
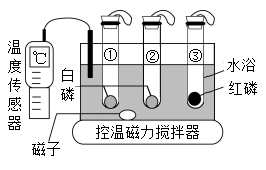
①发射时C2H8N2)与N2O4剧烈反应,生成二氧化碳、水和一种常见的气体单质。
②用液氢、液氧作推进剂时,为使两者恰好完全反应,则加注液氢、液氧的质量比为(最简整数比)。
①空间站中的氧气主要来自于电解水,在直流电源的(选填“正极”或“负极”)上产生氧气。
②宇航员呼出的二氧化碳用含氢氧化锂(LiOH)的过滤网吸收,生成碳酸锂(Li2CO3)和水,反应的化学方程式为。
①铝在空气中具有很好的抗腐蚀性能,原因是。
②常温下钛与稀硫酸不发生化学反应,则金属钛比金属铁的金属活动性(选填“弱”或“强”)。




a、冰水 b、热水 c、KClO3饱和溶液
资料:①无水氯化钙具有吸水性:
②常见铁的氧化物有关信息如表:
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色粉末 |
能否被磁铁吸引 | 否 | 否 | 能 |
③四氧化三铁能与稀盐酸反应:。
【实验探究】取适量的铁粉与湿棉花(棉花的成分不参加反应)于反应装置A中。按下图所示进行实验,试管内放一团湿棉花的目的是;实验时棉花没有燃烧,其原因是;观察到C处管口有淡蓝色火焰,烧杯内壁有水雾。说明产生的气体是。
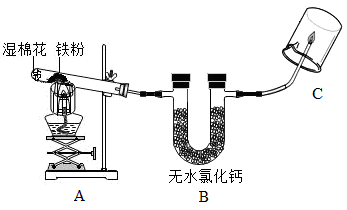
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想1:剩余固体是;
猜想2:剩余固体是Fe和Fe3O4。
“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有(选填序号)。
a、黄金面罩 b、象牙 c、青铜面具 d、丝织品
方法一:“火法炼铜”是将孔雀石【主要成分Cu2(OH)2CO3】与木炭一起加热,就得到红色的金属铜;
方法二:《淮南万毕术》中记载“曾青得铁则化为铜”,先用孔雀石制取硫酸铜,再用“湿法炼铜”获得铜。其流程如下:

方法一中涉及的反应方程式:;:
某碱式碳酸铜成分可表示为Cux(OH)Y(CO3)z,为探究其组成,用如图装置对样品27.1g进行热分解实验,观察到样品固体先变成黑色,然后部分出现红色。
资料:①浓硫酸具有吸水性,浓氢氧化钠溶液能充分吸收CO2。
②CuO加热会生成红色的Cu2O和O2。

装配好实验装置后,先要,再加入样品。
温度/℃ | 装置A | 装置B | 装置C | 装置D |
实验前/g | 227.1 | 100.0 | 100.0 | 100.0 |
实验后/g | 219.0 | 102.7 | 104.4 | 101.0 |
①该碱式碳酸铜的化学式为。
②最后装置A剩余固体中铜、氧元素质量比(最简整数比)。