 B . 点燃酒精灯
B . 点燃酒精灯 C . 检查气密性
C . 检查气密性 D . 加入大理石
D . 加入大理石

 B .
B .  C .
C .  D .
D . 
 B . 证明铁、铜、银金属活动性
B . 证明铁、铜、银金属活动性 C . 探究铁生锈需要氧气
C . 探究铁生锈需要氧气 D . 证明燃烧需要氧气
D . 证明燃烧需要氧气

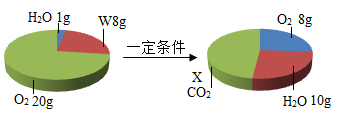
①脱碳法:煤燃烧前将水蒸气通过炽热的煤层,发生的反应之一为CO+H2OCO2+(请将化学方程式补充完整),然后在高压下将CO2进行分离捕集。
②吸收法:用石灰水进行化学吸收,该反应的化学方程式为。
①地质封存:将二氧化碳封存在地质层800m以下,使二氧化碳处于高密度的液态或超临界状态(气态和液态的共同体),用分子的观点解释这一过程。
②海洋封存:将捕获的二氧化碳直接注入深海,二氧化碳和水反应可以生成(写出物质的化学式)。







①在试管中加入2mL 5%的过氧化氢溶液,将带火星的木条伸入试管中,观察现象。 | 带火星的木条没有明显变化 |
②取1g氧化铜粉末放入 | 带火星的木条复燃 |
结论:氧化铜能加快过氧化氢的分解速率。
实验步骤 | 实验现象 |
待实验一第1步的试管中没有气泡时,重新加入2mL5%过氧化氢溶液,观察现象。 |
结论:氧化铜的化学性质在化学反应前后没有发生改变。
在实验后,该同学将反应剩余物过滤、洗涤、干燥,再称量,得到黑色固体质量为1 g。
结论:氧化铜的在化学反应前后没有发生改变。
某同学画出如图,表示有、无催化剂时,生成物质量与反应时间的关系图,你认为是否正确?(填“正确”或“不正确”)


