选项 | A | B | C | D |
目的 | 准确量取25.00mLNaOH溶液 | 测定中和热 | 粗铜精炼 | 比较 |
装置或操作 |
|
|
|
|


①
②
则a=。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
压强比 | 0.80 | 0.72 | 0.66 | 0.62 | 0.60 | 0.60 |
①用表示该反应
内的平均反应速率为。
②的平衡转化率为;T℃时,该反应的平衡常数为(保留到小数点后1位)。
③其它条件不变,下列措施能同时增大反应速率和平衡转化率的是。
a.升高温度 b.按原比例再充入一定量和
c.将和
液化移出 d.加入高效催化剂
④在30min时,再向体系里充入和0.2mol水蒸气,则反应(填“向正反应方向进行”、“向逆反应方向进行”或“保持平衡”)。
反应i | 反应ii | ||
①上表中=;
②的平衡常数K与上述反应速率常数
的关系式为;
1500K平衡体系中I(g)的分压为(保留到小数点后2位)。(已知:
表示平衡分压常数,即用平衡分压代替平衡浓度计算,某气体的分压
气体总压强
该气体的物质的量分数)。

①A电极为电池的极,写出A电极的电极反应式:。
②电池中
向移动(填“A电极”或“B电极”)。

①图中c为(填“阳”或“阴”)离子交换膜。
②已知电解池阴极室中溶液的pH在4~7之间,则阴极的电极反应为。
③用离子方程式表示吸收NO的原理。
④含稀
的废水中
的物质的量浓度为0.05mol/L,若电路中有10mol电子发生转移,则理论上最多可处理这样的废水L。
①基态钒原子的价电子排布式为。
②是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
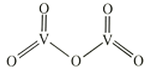
则分子中σ键和π键数目之比为。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
与
的空间构型相同,其中V原子的杂化方式为。
②是一种储氢材料。基态B原子核外电子的运动状态有种。
①中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
②甘氨酸 ()的沸点比相对分子质量相近的烷烃大很多,原因是。