 B . HClO的结构式:H-O-Cl
C . 基态碳原子的轨道表示式:
B . HClO的结构式:H-O-Cl
C . 基态碳原子的轨道表示式:A. | B. | C. | D. |
电解水 | 水力发电 | 太阳能热水器 | 干电池工作 |
|
|
|
|


X | |||
W | Y | R | |
Z |

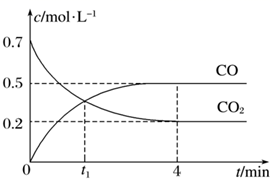


t/℃ | 700 | 800 | 900 | 1000 | 1200 |
K | 0.6 | 1.0 | 1.3 | 1.8 | 2.7 |
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验淀粉是否已经发生水解 | 将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH)2 , 加热,没有砖红色沉淀产生 | 淀粉未发生水解 |
| B | 探究KI与FeCl3反应的限度 | 取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液 | 若有白色沉淀产生, 则样品已经变质 |
| D | 检验气体Y | 用湿润的淀粉碘化钾试纸检验气体Y, | 试纸变蓝色,Y一定是Cl2 |
元素 | Mn | Fe | |
电离能/(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
a.CO32- b.ClO- c.CH3COO- d.HCO3-
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
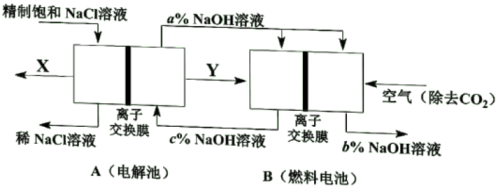
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。

已知:HCl与不发生反应;装置C中除生成
外,同时还生成一种有毒气态氧化物和少量
。其它相关信息如下表所示:
熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水溶性 | |
-24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 | |
-23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:→→b→→→d。
步骤一:取样品2.100g用稀硫酸充分溶解得到 , 再用足量铝将
还原为
, 过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用的
标准溶液滴定,将
氧化为
, 三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是。
②通过分析、计算,该样品的组成为。
![]() (g)
(g)
![]() (g)+H2(g)
(g)+H2(g)

