 B .
B .  C .
C .  D .
D . 
 B . 收集
B . 收集 C . 验满
C . 验满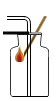 D . 检验
D . 检验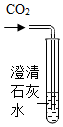
①氯化钠不干燥
②称取时,氯化钠放于右盘(使用了砝码和游码)
③所用砝码表面生锈
④用量筒量取水时仰视读数
⑤将配制好的溶液装入试剂瓶,有少量洒出
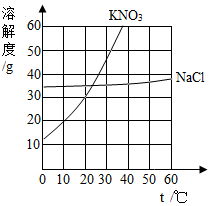
①O2② ③
③ ④
④


实验目的 | 实验操作 | |
A | 比较Fe、Cu、Ag的金属活动性 | 将Cu分别加入Fe(NO3)2和AgNO3溶液中 |
B | 检验CO2中混有的HCl气体 | 通入紫色石蕊试液,观察溶液是否变红 |
C | 除去Na2SO4溶液中少量的MgSO4 | 加入Ba(OH)2溶液至不再产生沉淀,过滤 |
D | 分离MnO2和KCl | 溶解、过滤、洗涤干燥;蒸发结晶 |

①衣:在化学纤维和天然纤维的表面镀上镍、铜等,可以对微波有一定的反射或吸收,有利于雷达定位,这种镀金属纤维属于材料。
②食:食盐主要成分是氯化钠,氯化钠是由构成(填微粒符号),食盐水的凝固点(填“高于”或“低于”)水的凝固点;一种生成氯化钠的化学方程式为 , 则NaClO2中氯元素的化合价为,X的化学式为。
③住:工业上用CO高温下还原磁铁矿制备建房材料,其反应的方程式为。
④行:格力新能源汽车的电池,充电6min可续航200km。在汽车行驶过程中,能转化为电能;汽车的行李箱盖利用了镁铝合金的性质(填序号)。
a.密度小、材质轻 b.导电性 c.抗腐蚀性能好
“碳中和”是指通过各种捕捉技术使排放到大气中的温室气体净增量为零。目前,CO2捕捉技术主要分为物理吸收法和化学吸收法。物理吸收法可用活性炭、沸石等对CO2进行吸收,化学吸收剂主要有氨水吸收剂(主要成分为NH3﹒H2O)、钙基吸收剂(主要成分为CaO)等,用氨水吸收剂时,控制30℃左右采用喷氨技术吸收CO2 , 生成碳酸氢铵;用钙基吸收剂时,控制560℃~700℃以捕捉CO2。
①活性炭、沸石等吸收CO2时是利用其具有性。
②采用喷氨技术吸收CO2时,温度不宜太高的原因为。(答一点即可)
③钙基吸收CO2时发生反应的方程式为。
④下列措施不利于实现“碳中和”目标的为。(填序号)
a.电脑长时间待机 b.研发新能源汽车 c.鼓励乘坐公交出行 d.多植树造林


步骤Ⅰ:关闭弹簧夹甲,打开弹簧夹乙和丙,滴加适量稀硫酸
步骤Ⅱ:反应一段时间后,关闭乙,打开甲和丙,继续滴加稀硫酸,观察到左瓶中液体入右瓶,关闭丙。
①步骤Ⅱ右瓶中还可以观察到的现象为,出现此现象的反应方程式为。
②步骤Ⅰ的目的为。

①A、B之间反应的化学方程式为。
②D物质的一种用途为。
①E物质俗称。
②A和B反应的现象为,属于反应(填基本反应类型)。

【提出猜想】猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl、Na2CO3;
猜想3:Na2SO4、NaCl和。
小麦同学观察到实验1中的现象为石蕊试液变为红色,得出结论:猜想成立。
小刘同学观察到实验2中产生白色沉淀,得出结论:猜想2成立。
同学们讨论后,认为实验2不能得出准确结论,其理由为。
取烧杯中的溶液20.0g,慢慢滴加溶质质量分数为40%的NaOH溶液,测得pH变化如图3,求溶液中HCl的质量分数。(写出详细计算过程)

①微观探析:图4是 NaHSO4与Ba(OH)2反应的微观示意图,根据图4写出Ba(OH)2与NaHSO4反应的方程式为。
②根据以上信息,同学们得出NaHSO4溶液呈性,为证明该结论可以使用酸碱指示剂和测pH的方法,请你再设计另一种方案证明该结论。