 B . 振荡试管
B . 振荡试管  C . 滴加液体药品
C . 滴加液体药品 
| 选项 | 物质(括号内为杂质) | 实验方案 |
| A | CuCl2溶液(CuSO4) | 加入过量的BaCl2溶液,过滤 |
| B | ZnCl2溶液(CuCl2) | 加入过量的锌粒,过滤 |
| C | Fe2O3固体(CuO) | 加入足量稀盐酸,过滤 |
| D | NaOH溶液[Ca(OH)2] | 加入过量的Na2CO3溶液,过滤 |
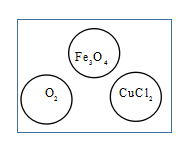
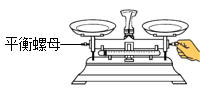
①每粒棋子代表一种物质;
②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;
③连吃:前一次反应的生成物能与另一棋子发生反应时,则另一棋子也被吃掉,欲将棋盘中的所有棋子连续吃掉,应选择的棋子是(反应条件忽略)
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 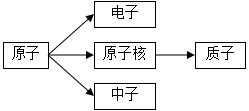
①施工过程中,为了不让一滴污水进入地下,工人师傅铺设了HDPE防渗膜,HDPE是种高密度聚乙烯塑料,它属于(填字母序号)。
A.金属材料 B.复合材料 C.有机合成材料 D.无机非金属材料
②施工完毕后剩余的塑料要集中回收再利用,否则会引起环境问题中的污染。
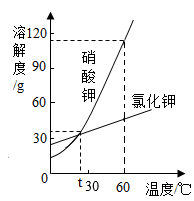
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 甲 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| 乙 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | |
请回答下列问题:
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
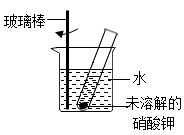
A 用少量水润湿滤纸,并使滤纸与漏斗壁之间留有气泡
B 漏斗下端的管口要紧靠烧杯内壁
C 玻璃棒要靠在三层滤纸的一边
D 滤纸边缘要低于漏斗口,液面要低于滤纸边缘
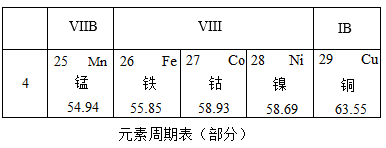
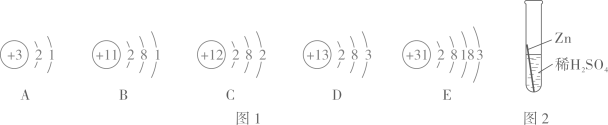
(提出问题)小倩同学产生疑问:为什么钴和铁都在第Ⅷ族呢?
(寻求帮助)
①钴元素在元素周期表中的原子序数为,一个钴原子比一个铁原子多一个(填序号)。
a.中子 b.电子 c.质子 d.电子层
②铁原子与钴原子具有相同的(填序号,下同)。元素的化学性质主要与原子的有关,因此二者的化学性质相似。
a.核电荷数b.核外电子数c.电子层数d.最外层电子数
③在化学反应中,金属钴和铁一样,也能与稀盐酸发生反应放出氢气,反应的化学方程式为:。钴在氧气中燃烧生成Co3O4 , 化学方程式为。
(设计并实验验)根据所学知识,同学们已知下列反应可以进行,并进行实验:
观察记录实验现象:氧化亚铁为黑色固体:实验a中,随着稀盐酸的加入,黑色固体逐渐溶解,溶液呈现浅绿色;实验b中,加入氢氧化钠溶液后出现白色沉淀,静置在空气中,沉淀物颜色发生变化,最后变为红褐色。
(查阅资料得知:原因是溶液中的Fe(OH)2遇空气中的氧气生成Fe(OH)3)
同学们欲探究钴元素化合物的性质,设计并进行了如下实验:
请你依据实验现象,完成下列问题:
Ⅰ.实验①中,取少量灰黑色的氧化钴放入试管中,加入稀盐酸,固体被溶解,溶液呈红色,写出反应的化学方程式。另取一支试管加入少量氧化钴,滴入浓盐酸,固体被溶解溶液呈绿色。说明反应后钴离子在溶液中呈现的颜色与加入酸的有关。
Ⅱ.实验②中,加入氢氧化钠溶液,出现青蓝色沉淀。将试管静置在空气中,沉淀物颜色发生变化,最终变为棕色,试推测沉淀物颜色变化可能与空气中的有关。通过实验探究,同学们得出结论:铁和钴两种元素的化合物化学性质相似。
查阅资料:
①蚁酸化学名称为甲酸(HCOOH),熔点为8.6℃,一定条件下加热分解生成两种物质;
②常温下,氯化钯(PdCl2)溶液常用于检验CO的存在:
(进行实验)向盛有蚁酸溶液的试管中滴加石蕊试液,变红色,结论:。
a.肥皂水 b.食醋 c.食盐水
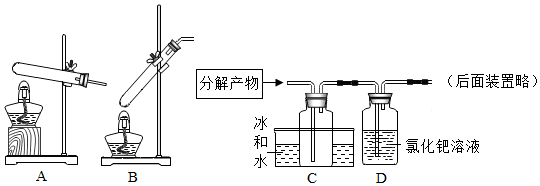
(设计实验)常温下,在一定条件下加热蚊酸应选择装置(填“A”或"B”);
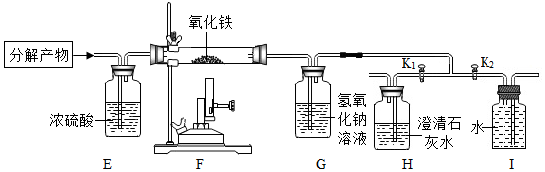
(拓展实验)排尽装置内的空气后,关闭K2 , 打开K1 , 点燃酒精喷灯,F处玻璃管内的现象:,
结论:一氧化碳具有还原性:此时H处瓶内无明显现象,证明二氧化碳在G处被完全吸收,分析该装置存在的缺陷:; 然后打开K2 , 关闭K1 , I处装置的作用是。

|
实验次数 |
1 |
2 |
3 |
4 |
|
加入氯化钡溶液的质量/g |
10 |
10 |
10 |
10 |
|
烧杯中所得溶液的质量/g |
28.03 |
36.06 |
44.09 |
54.09 |
第次实验,加入的氯化钡与碳酸钠恰好完全反应。