

 B .
B .  C .
C .  D .
D . 

|
|
|
|
A.粗盐提纯时蒸发结晶 | B.检查装置气密性 | C.收集氧气 | D.收集二氧化碳并验满 |


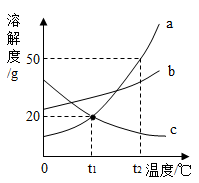
序号 | 实验内容 | 横坐标表示的量 | 纵坐标表示的量 |
A | 向铜、锌混合物粉末中加入盐酸 | 盐酸的质量 | 粉末的质量 |
B | NaOH溶液的稀释 | 水的质量 | 溶质的质量分数 |
C | 用稀盐酸除铁锈 | 稀盐酸的质量 | 铁锈的质量 |
D | 向Mg(OH)2固体中加入稀硫酸 | 稀硫酸的质量 | 固体的质量 |
|
选项 |
实验目的 |
实验操作 |
实验现象 |
实验结论 |
|
A |
研究温度对分子运动速率的影响 |
|
烧杯①中品红扩散速率比烧杯②中品红快 |
温度越低,分子运动速率越快 |
|
B |
鉴别NaCl和NH4NO3固体 |
分别取等量的a、b固体样品放入盛有等量蒸馏水的小烧林中,搅拌,测量溶解前后液体温度 |
加a的烧杯液体温度降低,加b的烧杯液体温度升高 |
a是NH4NO3 , b是NaCl |
|
C |
验证硝酸钾溶液的导电性 |
|
灯泡发亮 |
硝酸钾溶液中存在自由移动的离子,溶液能导电 |
|
D |
探究金属M生锈的条件 |
|
试管①中金属M生锈,试管②中金属M不生锈 |
金属M生锈需要氧气和水 |
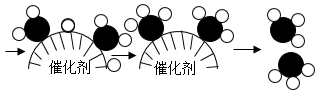
北京冬奥火炬“飞扬”在奥运火炬接力史上首次大规模使用氢燃料,凸显绿色办奥运的理念。按照制取过程及碳排放量的不同,制得的氢气可以分为“灰氢”“蓝氢”和“绿氢”。“灰氢”指采用化石燃料制取的氢气,石油、天然气、煤炭制氢等,制氢过程中有大量的碳排放。“蓝氢”指采用化石燃料制取,但过程中采用了碳捕捉及封存技术的氢气。“绿氢”指采用可再生能源(如风电、水电、太阳能等),通过电解制氢,制氢过程完全没有碳排放:

①与传统电解法制取氢气相比,该工艺的优点是。
②ZnFe2O4中铁元素的化合价为,其物质分类属于(填字丹)。
A.混合物 B.化合物 C.氧化物 D.碱 E.盐
③反应1的基本反应类型是,“循环制氢”中需要不断补充加入的物质是。“贮氢”中通入氩气作为保护气,体现氩气的性质为。
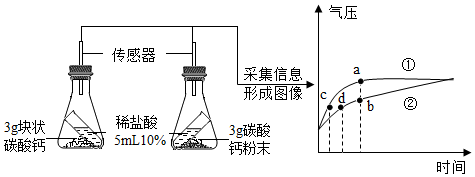
下列说法正确的是____(填字母)。
【猜想】
猜想1:Mn>Fe>Cu;猜想2:Fe>Cu>Mn;猜想3:。猜想4:Cu>Fe>Mn:猜想5:Cu>Mn>Fe:猜想6:Mn>Cu>Fe。
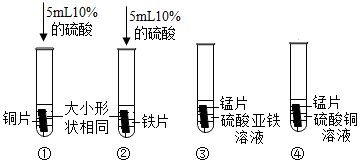
实验过程中发现只有实验①无明显现象。由此可得出猜想(填序号)是正确的。
已知金属锰和铁有相似的化学性质,能溶于稀酸,生成含有+2价金属离子的化合物。现将由5.5g金属锰、5.6g金属铁、6.4g金属铜组成的混合物放入一定量的稀硫酸中,充分反应后过滤得到固体12g,同时产生氢气的质量为g。

固体B中含有的物质是。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙、镁化合物。
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不同硬度的硬水。用蒸馏水和两种硬水完成三组实验,记录如下:
组别 | 第1组 | 第2组 | 第3组 | ||||||
实验操作 |
|
| |||||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
混合溶液用量/滴 | 0 | 0 | 0 | 1 | x | 1 | 2 | 2 | 2 |
肥皂水用量/滴 | 5 | 10 | 20 | 5 | 10 | 20 | 5 | 10 | 20 |
产生泡沫量 | 少 | 多 | 很多 | 无 | 少 | 多 | 无 | 无 | 少 |
【解释与结论】
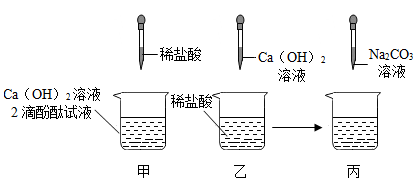
对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是。
a.取适量白色粉末加入足量的水,搅拌,得到白色沉淀和无色溶液。
b.取a中的白色沉淀,加入过量的稀盐酸,白色沉淀不溶解。
写出产生白色沉淀的化学方程式:。

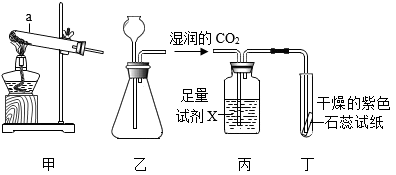
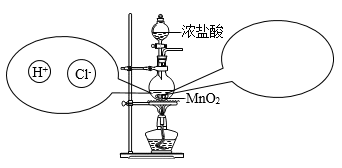
⑴实验室中常用加热二氧化锰和浓盐酸混合物的方法制取氯气: , 将反应时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求:不考虑空气、水)。
⑵氯气溶于水后得到的溶液称为氯水。氯气溶于水时,部分氯气会与水发生如下反应: 。氯水呈浅黄绿色,氯水含有多种溶质,因而具有多种性质。
已知:次氯酸(HClO)具有强氧化性,能够将有色物质(含酸碱指示剂)氧化为无色物质,但其酸性很弱,不能与碳酸盐反应。
请预测氯水的化学性质,说明预测的依据,并设计实验验证。
限选试剂:Na2SO4溶液、CaCO3固体、AgNO3溶液、紫色石蕊溶液、镁粉、铜片。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与含Ag+的可溶性盐反应 | 氯水中含有Cl- , Cl-能与Ag+反应生成难溶的AgCl | 取少量氯水于试管中,滴加AgNO3溶液,如果观察到,则预测成立。 |
②能够与(填物质类别)反应 | 取少量于试管中,滴加适量氯水,如果观察到,则预测成立 |