下列说法正确的是( )

t/s | 0 | 600 | 1200 | 1710 | 2220 | 2820 | x |
c(N2O5)/mol·L-1 | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
下列说法错误的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 往烧杯中加入研细的NH4Cl晶体和Ba(OH)2•8H2O晶体,并将其放在滴有水的玻璃片上,用玻璃棒理速搅拌混合物 | 产生刺激性气味气体,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定需要加热条件才能发生 |
B | 用导线将一块锌片和一块铜片连接起来,同时插入盛有稀硫酸的烧杯中 | 锌片逐渐溶解,铜片表面有气泡产生 | Zn和Cu均能与稀硫酸发生反应 |
C | 常温下,将铝片、铁片分别放入盛有浓硝酸的烧杯中 | 均无明显变化 | 常温下,Al和Fe均不能与浓硝酸发生反应 |
D | 将少量NH4Cl晶体放入试管底部在试管口塞上一团棉花,用酒精灯在试管底部药品处小火微热 | 试管底部的固体消失。试管口处的内壁上出现“白霜” | NH4Cl晶体依次发生了升华和凝华 |

已知:该装置中以熔融的金属氧化物作电解质,传感器工作时,O2-在电解质中定向移动。
①NiO电极上发生的是(填“氧化”或“还原”)反应。
②传感器工作时,电解质中的O2-向(填“NiO电极”或“Pt电极”)移动。
实验编号 | 温度/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
II | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
III | 350 | 1.20×10-3 | a | 82 |
已知:增大催化剂的比表面积可提高反应速率。
①表中a=。
②实验I和实验II中,NO的物质的量浓度c随甲时间t变化的关系如图所示,其中表示实验I的是曲线(填“甲”或“乙”)。


a.单位时间内消耗1molCO2的同时生成1molCH3OH
b.H2的物质的量浓度不再发生变化
c.容器内总压强不再发生变化
d.混合气体的密度不再发生变化

CaSO4与足量的NH3和CO2的混合原料气反应生成(NH4)2SO4。
①工业上在通入NH3和CO2的混合原料气发生反应前,常先将CaSO4固体粉碎,加水配成CaSO4浊液,目的是。
②为提高产品(NH4)2SO4的纯度,反应时应控制原料气中氨气和二氧化碳的体积之比=(填“2:1”、“1:1”或“1:2”)。
将反应所得混合物过滤得到主要成分为硫酸铵的滤液,滤渣为CaCO3。
①实验室进行过滤操作时,使用玻璃棒的作用是。
②煅烧过滤所得的滤渣可得到副产品CaO,该反应的△H0(填“>”、“=”或“<”)。
①结晶时应选用的实验操作是(填“蒸发结晶”或“蒸发浓缩、降温结晶”)。
②为进一步测定实验获得的(NH4)2SO4晶体中的含氮量,进行了以下实验:
准确称取2.8000g样品加入足量的NaOH溶液并充分加热,生成224.00mLNH3(标准状况),计算该产品中N元素的质量分数(写出计算过程)。
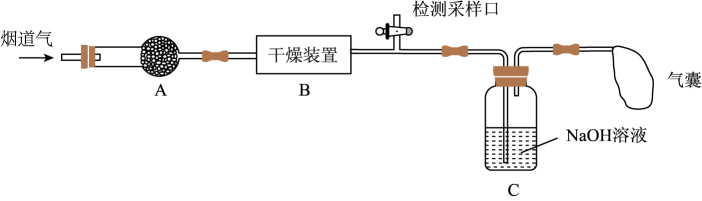
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
a.≥1 b.=1 c.≤1
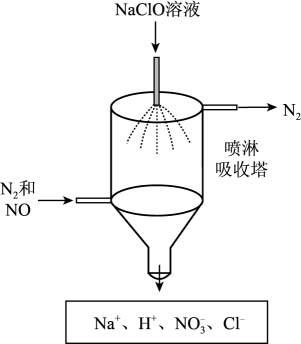
①NaClO溶液吸收NO时发生反应的离子方程式为。
②该装置的优点是。
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
氧化为NO
的离子方程式:。
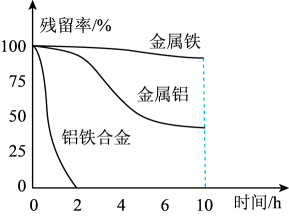
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO还原为N2 , 从而实现脱氮,溶液中NO
的残留率(残留率=
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是。