I1 | I2 | I3 | I4 | ...... |
740 | 1500 | 7700 | 10500 | ...... |






A.C6H5OH B.CH3OH C.CH3CH2OCH3 D.HOCH2CH2CH3
②化合物A和B的分子式都是C2H4Br2 , A的核磁共振氢谱如图所示,则A的核磁共振氢谱有组峰,请写出 B的结构简式。

①C分子的质谱图如图所示,从图中可知其相对分子质量是,则C 的分子式是。

②C能与NaHCO3溶液发生反应生成CO2 , 则C一定含有的官能团名称是。
③C与D互为有相同官能团的同分异构体。D的核磁共振氢谱有4组峰,峰面积之比是1: 1 :2:2,则D的结构简式是。
④0.5 molC与足量Na反应,产生的H2在标准状况下的体积是L。
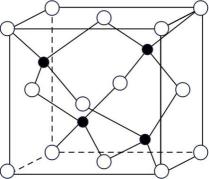
BN晶体中N原子的配位数是。若阿伏加德罗常数的值为NA , 该晶体的密度为ρg·cm-3 , 则晶胞边长a= pm(用含p和NA的最简式表示)。
①4NO(g)=2NO2(g)+N2(g) ∆H1= -293kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ∆H=kJ·mol-1 , 该反应能在下自发进行。(选填“低温”、“高温”或“任何温度”)
②恒温恒容时,能表明Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)达平衡状态的是 ( 填字母)。
A.单位时间内生成n mol CO同时消耗n mol CO2
B.c(CO)不随时间改变
C.CO2的体积分数不变
D.Fe 的浓度不变
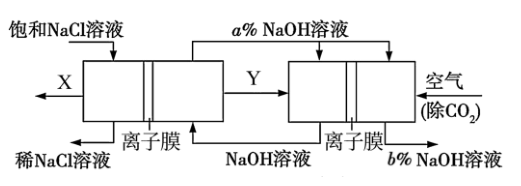
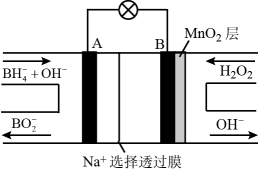
图中物质Y的电子式, 图中b%a%(填“<”或“>”或“=”),通入除去CO2的空气一极的电极反应式为。

查阅资料:
①亚硝酰氯的熔点为-64.5° C、沸点为-5.5 ℃,气态时呈黄色,液态时呈红褐色。
②亚硝酰氯遇水易反应生成一种氯化物 和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
该反应中被还原与被氧化的物质的物质的量之比为。

组装好实验装置后应先检查装置气密性,然后装入药品。一段时间后,两种气体在装置Z中反应的现象为。
配制溶液时除使用烧杯、玻璃棒、胶头滴管、量筒外,还需用到的玻璃仪器是;当滴入最后半滴AgNO3标准溶液后,出现且半分钟内不消失,即达到滴定终点。