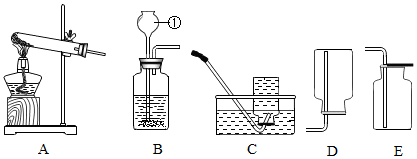
 加热固体
B .
加热固体
B .  二氧化碳的验满
C .
二氧化碳的验满
C .  检查装置气密性
D .
检查装置气密性
D .  滴加液体
滴加液体

| 化学方程式 | 反应类型 | |
| A | H2O | 分解反应 |
| B | CaO+H2O= Ca(OH)2 | 化合反应 |
| C | 2Fe+6HCl= 2FeCl3+3H2↑ | 置换反应 |
| D | SO3+2NaOH=Na2SO4+H2O | 复分解反应 |


A 静置沉淀 B 吸附沉淀 C 蒸馏 D 过滤

物质 | NaOH溶液 | NaCl溶液 | K2CO3溶液 | Ba(NO3)2溶液 |
能否反应 | 能 | 不能 | 能 | 能 |
实验现象 | 无明显现象 | 无明显现象 | 产生气泡 | 产生白色沉淀 |
【设计实验】在老师的指导下,同学们向少量稀硫酸中逐滴加入过量NaOH溶液,并进行了如下分组实验:
组号 | 操作 | 实验现象 | 结论 |
1 | 用pH试纸测定实验前后溶液的pH | pH由1变至9 | 能反应 |
2 | 向反应后的溶液中加入适量Ba(NO3)2溶液 | 溶液产生白色沉淀 | 不能反应 |
3 | 向反应后的溶液中加入适量K2CO3溶液 | 能反应 |
若开始时将pH试纸用蒸馏水润湿。则测得的稀硫酸的pH将(填“偏大”、“偏小”或“不变”)。
【实验反思】向NaOH溶液中通入少量CO2 . 再向其中加入,有气泡产生,即可证明NaOH与CO2发生了反应。
次数 | 第一次 | 第二次 | 第三次 |
加入稀硫酸质量/g | 5 | 5 | 5 |
生成氢气质量/g | 0.02 | 0.02 | 0.01 |
请计算: