


 B .
B . ![]() 与
与 ![]() 中含σ键个数比为3:2
中含σ键个数比为3:2

| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 测定NaHCO3的浓度 | 酸式滴定管、锥形瓶、烧杯 | 待测NaHCO3溶液、标准盐酸溶液、甲基橙指示剂 |
| B | 检测稀硫酸作用后的淀粉是否水解 | 试管、胶头滴管、酒精灯 | 氢氧化钠溶液、硫酸铜溶液 |
| C | 对比Fe3+、Cu2+对H2O2分解的催化效果 | 试管、胶头滴管 | 5%H2O2溶液、0. 1 mol/L Fe2(SO4)3溶液、0.1 mol/L CuSO4溶液 |
| D | 除去粗盐中的 | 试管、普通漏斗、胶头滴管 | 稀盐酸、BaCl2、Na2CO3溶液 |
![]()



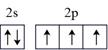
①其中C、N、O、Zn元素的第一电离能大小关系是,结构中参与sp3杂化原子有个。
②配位键①和②相比。较稳定的是;键角③键角④(填“>”、“<”、“=”)。

①图a纤锌矿型ZnO晶体中O2-的配位数为。
②闪锌矿型中Zn2+填入O2-所形成的“正四面体”空隙中,闪锌矿晶胞中含有个“正四面体”空隙。
③图b闪锌矿型晶胞密度为ρg/cm3.则Zn2+与O2-的距离为nm。(设NA为阿伏加德罗常数的值)

浸出液用H2SO4调节pH的最佳范围是。
调pH时 转化的离子方程式为。

ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ.……… △H4
①反应ⅳ的化学方程式为。
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H13△H2(填“>”、“<”或“=”)。

③有助于制取低价钛离子的电解质熔盐的措施为。

①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为。
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=。
③若向此平衡体系中继续注入TiCl4 , 则再次平衡后 (填“增大”、“减小”或“不变”)

硫渣的化学组成
| 物质 | Sn | Cu2S | Pb | As | 其他杂质 |
| 质量分数% | 64.43 | 25.82 | 7.34 | 1.23 | 1.18 |
氯气与硫渣反应相关产物的熔沸点
| 物质 性质 | SnCl4 | CuCl | PbCl2 | AsCl3 | S |
| 熔点/℃ | -33 | 426 | 501 | -18 | 112 |
| 沸点/℃ | 114 | 1490 | 951 | 130 | 444 |
①AsCl3+3H2O= H3AsO3+ 3HCl
②H3AsO3+I2+H2O= H3AsO4+2HI
③2 +I2=2I-+
则产品中SnCl4的质量分数(保留小数点后1位);若滴定后发现滴管尖嘴处产生了气泡,则测量结果(填“偏高”或“偏低”)。
a能与FeCl3溶液显紫色
b.核磁共振氢谱有4组峰,且峰面积比为9: 3: 2: 2
 的路线(无机试剂任选) 。
的路线(无机试剂任选) 。