X | Y | ||
Z | W |
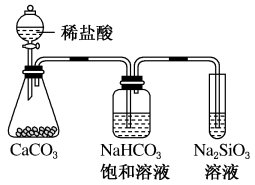
|
|
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸溶液 |
|
B |
铜 |
铁 |
稀盐酸溶液 |
|
C |
银 |
锌 |
硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁溶液 |
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | —— |
B | 水浴加热 | 3% | —— |
C | 水浴加热 | 6% | |
D | 常温 | 6% | —— |


族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ⑩ | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
上述反应属于放热反应的是_______(填“A”或“B”)。
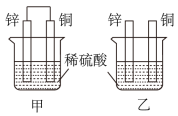
①在甲乙两个烧杯中,甲铜极上发生反应(填“氧化”或“还原”),乙在表面产生气泡(填“”或“
”)。
②能构成原电池的是装置(填“甲”或“乙”),其中负极为电极(填“”或“
”)。
③两个装置中均被腐蚀,若转移
电子,理论上
片质量减轻g。
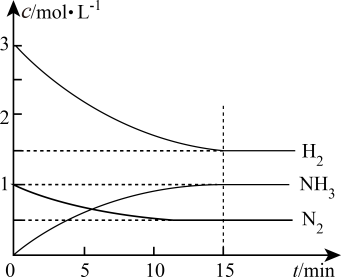
内,平均反应速率
为。
实验内容 | 实验现象 |
①各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
②各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是,则下列判断正确的是( )
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
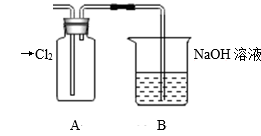
①装置A中盛放的试剂是(填选项),化学反应方程式是。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
②下列不能用于验证氯元素比硫元素非金属性强的依据为(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3 , 而硫与铁反应生成FeS
③若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,。
实验方案:用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/ | 收集 |
Ⅰ | 薄片 | 15 | 200 |
Ⅰ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①实验Ⅰ和Ⅱ表明,化学反应速率越大;
②能表明固体的表面积对反应速率有影响的实验编号是和;
③请设计一个实验方案证明盐酸的浓度对该反应速率的影响:。
i.向溶液中滴加5~6滴
溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加 , 充分振荡;
iii.向乙中滴加试剂X。
①将和
反应的离子方程式补充完整:。
②步骤ⅲ中,试剂X是。
③步骤ⅱ和ⅲ中的实验现象说明和
混合时生成
、
和
的反应存在一定的限度,该实验现象是。