 B . N2的结构式: N ≡N
C . 核内有12个中子的Na:
B . N2的结构式: N ≡N
C . 核内有12个中子的Na:

 和
和 两者互为同分异构体
B .
两者互为同分异构体
B . 
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中先加入几滴KSCN溶液,再通入氯气 | 开始无明显现象,后溶液变红 | 溶液中一定含Fe2+ , 一定不含Fe3+ |
B | 向BaCl2 溶液中通入SO2气体 | 有白色沉淀生成 | 该白色沉淀为BaSO3 |
C | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性: S>C |
D | 在火焰上灼烧搅拌过某无色溶液的铂丝 | 火焰出现黄色 | 该溶液一定是钠盐溶液 |
|
|
|
|
A.升高温度,平衡常数减小 | B.0~3 s内,反应速率为v(NO2)=0.2 mol·L-1 | C.t1时仅加入催化剂,平衡正向移动 | D.t1时刻,该反应达平衡状态 |
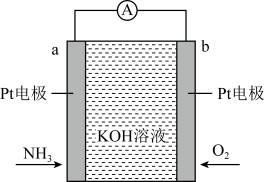


已知:
①C(石墨,s)+CO2(g)=2CO(g) △H= +172.5 kJ·mol-1
②3C(石墨,s)+Fe2O3(s)=2Fe(s)+3CO(g) △H= +489.0 kJ·mol-1
则CO还原Fe2O3的热化学方程式为。
①以下能说明该可逆反应达到平衡状态的是 (选填字母)。
A.v正(CO)= v逆(CO2) B.容器内气体压强一定
C.CO与CO2浓度比为1∶1 D.Fe的质量不变
②若要提高CO的平衡转化率,可以采取的措施是(写任意一个即可)

①压强:p1p2 , △H0(填“>”、“<”或“=”)
②1100℃、p1条件下,反应的平衡常数K=若在平衡体系再充入0.6molCO2和0.8molH2 , 此时v正 v逆(填“大于”, “小于”或者“等于”)