选项 | 气体(杂质) | 方法 |
A | Cl2(HCl) | 通过饱和的食盐水 |
B | N2(O2) | 通过足量灼热的铜丝网 |
C | SO2(CO2) | 通过饱和的碳酸氢钠溶液 |
D | NH3(H2O) | 通过盛有碱石灰的干燥管 |





已知:①As2O3为酸性氧化物;②As2S3易溶于过量的Na2S溶液中,故加入FeSO4 , 的目的是除去过量的S2-。
回答下列问题:

I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
滴液漏斗中支管的作用为。
| NH3 | MgCl2 | MgCl2•NH3 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
生成MgCl2•6NH3的反应需在冰水浴中进行,其可能原因有____(填字母)。
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20的AgNO3标准液滴定溶液中
, 记录消耗标准液的体积;
步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
步骒1中,用稀硝酸溶解样品的目的为。

①T1时,前0.5 min内平均反应速率v(CO)=
②b点和d点的化学平衡常数:Kb (填“>”“<”或“=”)Kd。
③b点时,CO的转化率为。
④下列能说明反应达到平衡的是(填字母)。
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率
D.混合气体的平均相对分子质量不再改变

①反应釜发生的反应中,SO2表现出。
②反应釜中采用“气—液逆流”接触吸收法的优点是。
③工业上常加Ni2O3作催化剂,催化过程如图3所示。在催化过程中,反应产生的四价镍和氧原子具有强氧化能力,能加快吸收速度。试写出过程2的反应方程式:
 B .
B .  C .
C .  D .
D . 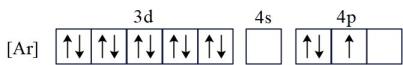
①的空间构型为 ,EDTA中碳原子杂化方式为 。
②C、N、O、S四种元素中,第一电离能最大的是。
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型,该化合物加热时首先失去的组分是。

有机物 | 甲醇 | 甲硫醇(CH3SH) | 甲硒醇 |
沸点/℃ | 64.7 | 5.95 | 25.05 |

①含有两个甲基;②含有酮羰基(但不含C=C=O);③不含有环状结构。
 的合成路线(无机试剂和不超过2个碳的有机试剂任选):。
的合成路线(无机试剂和不超过2个碳的有机试剂任选):。